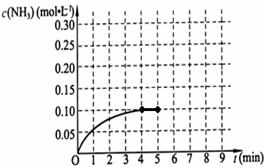
-
下列说法正确的是( )
A.需要加热的化学反应都是不自发反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.太阳能电池是将化学能转化为电能的过程
难度: 简单查看答案及解析
-
对于在一定条件下放热的可逆反应来说,升高温度( )
A.正、逆反应速率都加快 B.仅逆反应速率加快
C.仅正反应速率加快 D.正反应速率减慢,逆反应速率加快
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.酸与碱恰好完全反应生成正盐的溶液
C.使石蕊试液呈紫色的溶液 D.c(H+)=c(OH-)=10-6mol/L溶液
难度: 中等查看答案及解析
-
下列关于电离常数(K)的说法中正确的是( )
A.电离常数(K)越小,表示弱电解质电离能力越弱
B.电离常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离常数(K)不同
D.多元弱酸各步电离常数相互关系为:K1<K2<K3
难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
难度: 中等查看答案及解析
-
决定化学反应速率的主要因素是( )
A.反应物的浓度 B.温度、压强以及反应物的接触面积
C.催化剂 D.参加反应的物质本身的性质
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是( )
A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定
B.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液
C.用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入
难度: 中等查看答案及解析
-
下列关于原电池的叙述中,正确的是
A.原电池中,正极就是阳极,负极就是阴极
B.原电池工作时,在负极上发生氧化反应
C.原电池工作时,溶液中的阳离子向负极移动
D.电流从负极沿外电路流向正极
难度: 中等查看答案及解析
-
有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液。若将甲蒸发掉一半水,在乙中
通入少量CO2,丙不变,然后滴加指示剂甲基橙后,用同浓度的H2SO4溶液滴定至完全反应
后,所需溶液的体积大小关系为 ( )
A.甲=乙=丙 B.丙>乙>甲 C.乙>丙>甲 D.甲=丙>乙
难度: 简单查看答案及解析
-
将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.c (HCN)<c (CN-) B.c (Na+) = c (CN-)
C.c (HCN)-c (CN-)=c (OH-) D.c (HCN)+c (CN-)=0.1mol·L-1
难度: 简单查看答案及解析
-
常温下,下列各组离子在溶液中一定能大量共存的是( )
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl—、SO42—
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3—
C.由水电离产生的c(H+)=10—13mol/L的溶液:NH4+、Ba2+、AlO2—、Cl—
D.pH=12的溶液:K+、Na+、CH3COO-、Br—
难度: 简单查看答案及解析
-
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
用铂(惰性)电极进行电解,下列说法中正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是 ( )
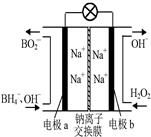
A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
难度: 中等查看答案及解析
-
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态: 2A(?)+ B(?)
xC(g) ΔH<0平衡时M中A、B、C的物质的量之比为 1∶3∶2。下列判断正确的是
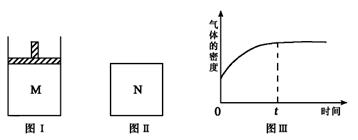
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率大于N中A的转化率
难度: 困难查看答案及解析
-
下列推论正确的是( )
A.S(g)+O2(g) =SO2(g) ΔH=a;S(s)+O2(g) =SO2(g) ΔH=b;则a>b
B.C(石墨,s) =C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定
C.NaOH(aq)+HCl(aq) =NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.CaCO3(s) =CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行
难度: 中等查看答案及解析
-
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
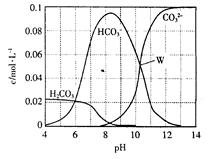
A.W点所示的溶液中:c (Na+)+c (H+)="2c" (CO32— )+c (OH— )+c (Cl— )
B.pH= 4的溶液中:c (H2CO3)+c (HCO3—)+c (CO32—)<0.1mol·L—1
C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3—)=" c" (OH— )+c (Cl— )
D.pH=11的溶液中:c (Na+)>c (Cl— )>c (CO32— )>c (HCO3— )>c (H2CO3)
难度: 困难查看答案及解析
-
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )
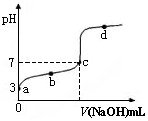
A.a点时,CH3COOH的电离度是1%
B.b点时,溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中
均等于K
难度: 困难查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
容器编号
起始时各物质的物质的量/mol
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15 kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是 ( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器 ① 的体积为0.5 L,则平衡时放出的热量小于23.15 Kj
难度: 困难查看答案及解析