-
下列说法正确的是
A.含有食品添加剂的食物对人体健康均有害
B.普通玻璃和氮化硅陶瓷都属于新型无机非金属材料
C.大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI
难度: 中等查看答案及解析
-
下列说法错误的是
A.纯铁的抗腐蚀能力比生铁强
B.可用酒精洗涤附着在试管内壁上的固态硫
C.用惰性电极电解熔融NaCl可获得金属钠
D.二氧化硅能与NaOH溶液反应,所以盛放碱液的试剂瓶不能用磨口玻璃塞
难度: 中等查看答案及解析
-
下列关于元素周期表和元素周期律的说法正确的是
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
难度: 中等查看答案及解析
-
下列实验操作、现象及结论均正确的是
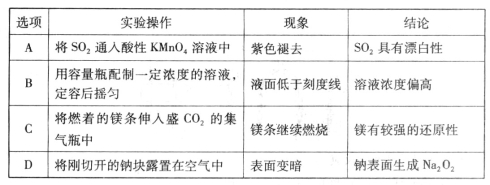
难度: 中等查看答案及解析
-
下列说法错误的是
A.任何化学反应都伴随着能量变化
B.电解质溶液的导电过程就是电解的过程
C.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
D.胶体和溶液的本质区别是能否发生丁达尔现象
难度: 中等查看答案及解析
-
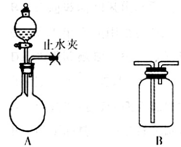
利用下列装置进行相应实验,不能达到实验目的的是
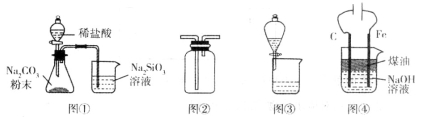
A.图①装置可验证酸性:H2CO3>H2SiO3
B.图②装置可用于收集气体H2、CO2、Cl2、NH3
C.图③装置可用于分离互不相溶的两种液体
D.图④装置可制备Fe(OH)2并能较长时间保持其颜色
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向CuCl2溶液中加入少量氨水:Cu2++2OH一=Cu(OH)2↓
B.向海带灰的浸出液中(酸性)加入双氧水制取I2:2I一+H2O2+2H+=I2+2H2O
C.足量稀硫酸与氢氧化钡溶液混合:Ba2++OH一+SO
+H+=BaSO4↓+H2O
D.铝溶于氢氧化钠溶液:2Al+2OH一+3H2O=2[Al(OH)4]一+3H2 ↑
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA
B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA
C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA
难度: 中等查看答案及解析
-
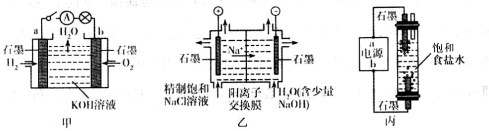
某同学组装如图所示电化学装置,电极I为Zn,其它电极均为Cu。下列说法错误的是
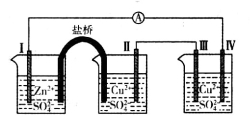
A.电极I发生氧化反应
B.相同的时间内,电极Ⅱ与Ⅳ质量变化相同
C.电极III的电极反应:4OH――4e-=2H2O+O2↑
D.电流方向:电极Ⅳ→
→电极I
难度: 中等查看答案及解析
-
四种短周期元素在元素周期表中的相对位置如图所示,
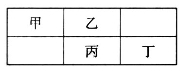
其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是
A.四种元素的单质中,丙单质的熔、沸点最高
B.丁元素氧化物对应水化物的酸性一定强于丙
C.乙元素形成的单核阴离子还原性强于丙
D.丁元素单质在化学反应中只表现氧化性
难度: 中等查看答案及解析
-
下列说法正确的是
A.将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为l mol·L-1
B.将100 mL 2 mol·L-1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol·L-1
C.将l0 mL l.0mol·L-1NaCl溶液与90mL水混合,所得溶液的浓度为0.1 mol·L-1
D.将10 g CaO加入100 mL饱和石灰水中,充分搅拌、静置并恢复到原来的温度,所得溶液的浓度不变
难度: 中等查看答案及解析
-
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于
Y的说法错误的是
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.
Y 和
Y 是两种不同的核素
难度: 简单查看答案及解析
-
下表中的事实与推论不符的是
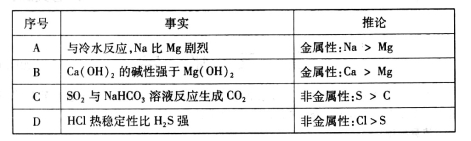
难度: 中等查看答案及解析
-
C、N、S是重要的非金属元素,下列说法正确的是
A.实验室用铜和浓硝酸反应制取NO
B.三种元素均可以和氧元素形成多种氧化物
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.稀硫酸、稀硝酸与铁的反应均属于置换反应
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.0.1mol·L-1FeCl3溶液中能大量存在Fe2+、NH4+、SCN一、SO42-
B.酸性溶液中可能大量存在Na+、ClO一、SO42-、I—
C.碱性溶液中能大量存在Mg2+、Cu2+、SO42-、NO3—
D.加入铝粉能产生氢气的溶液中可能大量存在NH4+、Fe2+、SO42-、Cl一
难度: 中等查看答案及解析
-
11.2 g Cu在某浓硝酸中完全溶解,反应产生NO2和NO混合气体3.36L(标准状况),则混合气体中NO2和NO的体积比为
A.1:l B.1:2 C.1:3 D.2:l
难度: 中等查看答案及解析