-
用已知物质的量浓度的HCl溶液滴定未知浓度的NaOH溶液时,下列操作会导致测定结果偏高的是
①酸式滴定管用蒸馏水洗后未用待装液润洗;②碱式滴定管用蒸馏水洗后未用待装液润洗;③滴定前酸式滴定管尖嘴处未充满溶液,滴定终点充满溶液;④取碱液时滴定管尖嘴处未充满溶液,取完后,充满溶液;⑤锥形瓶用蒸馏水洗后再用待测液润洗;⑥滴定时摇动锥形瓶将液体溅出瓶外;⑦滴定过程中,滴定管漏出液体,溅至锥形瓶外;⑧读取标准溶液体积时,滴定前仰视,滴定后俯视。
A.②④ B.①③⑤⑦ C.④⑧ D.②④⑥⑧
难度: 中等查看答案及解析
-
下列关于能源的说法不正确的是
A.煤的干馏是物理变化,煤的气化和液化是化学变化
B.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
C.沼气(主要成分是CH4)是可再生能源
D.太阳能、氢能、风能、地热能、生物质能都是新能源
难度: 简单查看答案及解析
-
在298K、1.01×105Pa下,将22gCO2通入750ml1mol/LNaOH溶液中充分反应,测得放出xkJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ/mol
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ/mol
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ/mol
D.2CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y)kJ/mol
难度: 困难查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=+64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于
A.-417.91kJ·mol-1 B.-319.68kJ·mol-1 C.+546.69kJ·mol-1 D.-448.46kJ·mol-1
难度: 困难查看答案及解析
-
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是
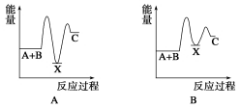
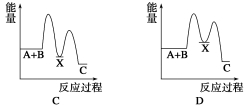
难度: 中等查看答案及解析
-
根据以下3个热化学方程式
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S
(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
难度: 中等查看答案及解析
-
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反
应速率
难度: 中等查看答案及解析
-
足量块状铁与100 mL 0.01 mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的①加H2O ②加NaOH固体 ③加CH3COONa固体 ④加Na2CO3固体 ⑤加入NaNO3固体 ⑥加NaCl溶液 ⑦滴入几滴硫酸铜溶液 ⑧升高温度 ⑨将块状铁改为铁粉 ⑩将稀硫酸改用98%的浓硫酸
A.⑧⑨⑩ B.⑦⑧⑨ C.③⑦⑩ D.⑦⑧⑩
难度: 中等查看答案及解析
-
可
逆反应:2NO2(g)
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2
的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO
2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
难度: 中等查看答案及解析
-
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s) + 2NO(g)
CO2(g) + N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
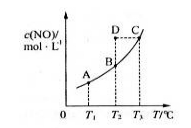
A.该反应的△H>0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.若状态B、C、D的压强
分别为PB、PC、PD,则PC=PD>PB
D.在T2时,若反应体系处于状态D,则此时
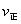
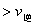
难度: 困难查看答案及解析
-
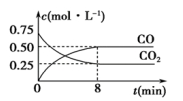
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图
所示。下列叙述正确的是
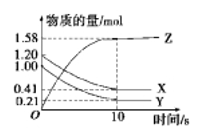
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析
-
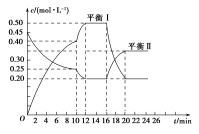
密闭容器中进行的可逆反应:aA(g)+bB(g)
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
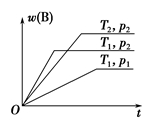
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
难度: 困难查看答案及解析
-
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
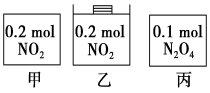
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
难度: 困难查看答案及解析
-
下列反应能用勒沙特列原理解释的是
A.由SO2和O2反应制SO3需使用催化剂
B.燃烧粉碎的黄铁矿矿石有利于三氧化硫的生成
C.硫酸生产中用98.3%的硫酸吸收SO3,而不用水或稀硫酸吸收SO3
D.用氮气和氢气合成氨需采用高压
难度: 中等查看答案及解析
-
下列说法错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
D.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>0
难度: 中等查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
A.平衡向正反应方向移动 B.a+b > c+d
C.Z的体积分数变大 D.X的转化率变小
难度: 中等查看答案及解析
-
在一固定容积的密闭容器中,加入4 L X(g)和6 L Y(g),发生如下反应:X(g) + nY(g)
2R(g) + W(g),反应达到平衡时,测知X和Y的转化率分别为25%和50%,则化学方程式中的n值为
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2
2NH3。在一定温度下达到平衡,H2的转化率为20%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
A.15mol 20% B.20mol 20% C.20mol 80% D.40mol 80%
难度: 困难查看答案及解析
-
下列说法中,正确的是
A.强电解质的水溶液一定比弱电解质溶液的导电能力强
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.强电解质
的水溶液中不存在溶质分子
D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质
难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.
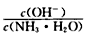 B.
B.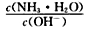 C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量难度: 中等查看答案及解析
-
常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
难度: 困难查看答案及解析
-
某同学将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与
该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A. 12:l B.1l:1 C.10:1 D.9:1
难度: 中等查看答案及解析
-
常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是
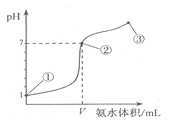
A.盐酸的物质的量浓度为1mol/L
B.在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)
C.在点③所示溶液中:由水电离出的c(O
H﹣)>10﹣7mol/L
D.在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V <20
难度: 困难查看答案及解析
-
常温下,下列有关离子浓度及pH大小的比较正确的是
A.NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>①
B.由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7
D.pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7
难度: 困难查看答案及解析
-
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 m
ol·L-1 NaOH溶液,pH变化曲线如图所示(忽略温度),以下叙述正确的是
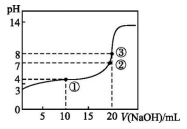
A.根据图中数据可计算出K值约为1×10-5
B.①②③点水的电离程度由大到小的顺序为:②>③>①
C.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③时c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
难度: 困难查看答案及解析