-
三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其他 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
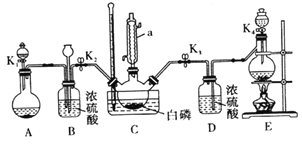
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
-
硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:

已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4 和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6 的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 
| 10℃ | 20℃ | 40℃ | 60℃ |
| MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
| CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
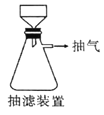
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100 g,得到MgSO4·7H2O为172.2 g,则MgSO4·7H2O 的产率为__________。
-
甲醇和水蒸气制取H2 的反应如下:
反应Ⅰ(主):CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49 kJ/mol
CO2(g)+3H2(g) △H1=+49 kJ/mol
反应Ⅱ(副):H2(g)+CO2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CH3OH(g) CO(g)+2H2(g) △H3=+90kJ/mol
CO(g)+2H2(g) △H3=+90kJ/mol
(1)△H2=_________(填选项序号)。
(2)下列有关反应Ⅰ的说法不正确的是________。
a.恒温、恒压条件下,在反应体系中充入He,平衡不移动
b.恒温、恒容条件下,容器内的压强不发生变化反应达到平衡
c.反应达平衡时,H2的消耗速率是CO2 的消耗速率的3 倍
d.温度不变,减小压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动
(3)在一体积不变的密闭容器中,充入2.0 mol CH3OH(g)和1.0molH2O(g),达平衡后,再加入1.0mol CH3OH(g)和0.5mol H2O(g),在相同温度下,再达平衡时,甲醇的转化率______(填“增大”“ 减小”或“不变”)。
(4)催化剂不仅可以改变化学反应速率,还有一种特性叫“催化剂的选择性”。下图为某催化剂作用下,CH3OH 转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率与平衡状态生成率相差较大的原因是催化剂对_____________(填“反应Ⅰ”或“反应Ⅱ”)的选择性低。
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是___________。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_______________。
(5)250℃,一定压强和催化剂条件下,在1L的容器中1.00mol CH3OH 和1.32 mol H2O充分反应(忽略反应Ⅲ),平衡时测得H2 为2.70mol,CO为0.030mol,H2O为0.44mol,列式计算反应Ⅱ的平衡常数K=___________(结果保留两位有效数字)。
-
[化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________。
(2)下列各项比较中,Mg>Al的是____________(填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。
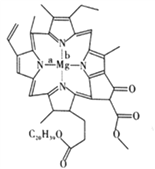
①Mg2+与N原子形成的化学键为配位键的是__________(填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________。
(4)MgO具有NaCl 型结构(如图),MgO晶体的熔点比NaCl 高的原因是________________;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________,r(O2-)=0.148mm,MgO的密度为___________ g/cm3(NA表示阿伏加德罗常数的值,列出计算式)。

-
[化学-选修5:有机化学基础]化合物M 是合成香精的重要原料。实验室由A 和芳香烃E制备M 的一种合成路线如下:
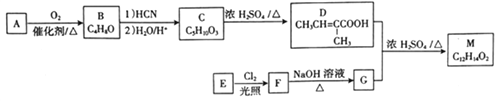
已知: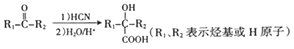
请回答下列问题:
(1)A 的化学名称为___________,F 的结构简式为______________。
(2)B 中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M 的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以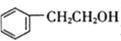 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备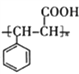 的合成路线______________________。
的合成路线______________________。


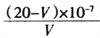




 CO(g)+2H2(g) △H3=+90kJ/mol
CO(g)+2H2(g) △H3=+90kJ/mol



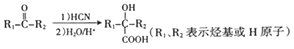
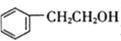 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。