-
下列物质属于复合材料的是
A.普通玻璃 B.普通钢 C.玻璃钢 D.镁铝合金
难度: 中等查看答案及解析
-
月球土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于
He的说法正确的是
A.
He原子核内含有2个中子 B.
He原子核内含有3个质子
C.
He原子核外有3个电子 D.
He和
He是两种不同的核素
难度: 中等查看答案及解析
-
在下列所表示的微粒中,得电子能力最强的是
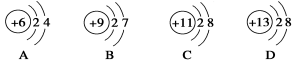
难度: 中等查看答案及解析
-
下列反应中,生成物的总能量大于反应物的总能量的是
A.氢气在氧气中燃烧 B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧 D.铁丝在氧气中燃烧
难度: 中等查看答案及解析
-
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于
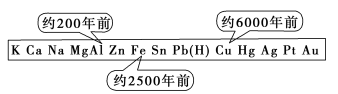
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
难度: 中等查看答案及解析
-
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合
物,根据下列四种金属的熔沸点:
Na
Cu
Al
Fe
熔点
97.5.C
1083℃
660℃
1535℃
沸点
883℃
2595℃
2200℃
3000℃
其中不能形成合金的是
A.Cu和Na B.Fe与Cu C.Cu与Al D.Al与Na
难度: 中等查看答案及解析
-
下列有关周期表的叙述中正确的是
A.碱土金属元素是指ⅡA族的所有元素
B.除第一周期外,其他周期均有18种元素
C.过渡元素都是副族元素
D.主族元素的原子,半径越大,越容易得到电子
难度: 中等查看答案及解析
-
下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是
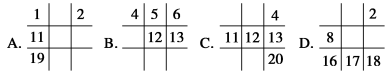
难度: 中等查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1 mol H2中的化学键消耗
的能量为Q1kJ,断裂1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学
键释放的能量为Q3 kJ。下列关系式中一定正确的是
A.Q1+Q2<Q3 B.Q1+Q2>2Q3
C.Q1+Q2=2Q3 D.Q1+Q2<2Q3
难度: 中等查看答案及解析
-
两种粒子的质子数、电子数分别相等,它们不可能是
A.两种离子 B.一种原子和一种分子
C.一种分子和一种离子 D.一种单质分子和一种化合物分子
难度: 中等查看答案及解析
-
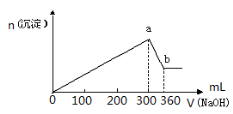
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
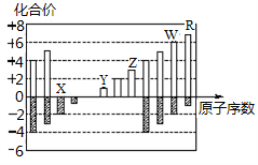
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成离子化合物
D.Y和Z两者最高价氧化物对应的水化物不能相互反应
难度: 中等查看答案及解析
-
下列物质中,化学键类型完全相同的是
A.CaBr2与HCl B.MgCl2与Na2S
C.KOH与NaCl D.H2O与NaCl
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+ 、 cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子序数:d>c>b>a
B.原子半径:r (A)>r (B) >r (D)> r (C)
C.单质的还原性:A>B >D>C
D.离子半径:r (C3-)>r (D-)>r (B+)>r (A2+)
难度: 中等查看答案及解析
-
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c皆能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
A.Fe Cu Al Ag Mg B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe D.Mg Ag Al Cu Fe
难度: 中等查看答案及解析
-
下列各组离子在给定条件下能大量共存的是
A.强酸性溶液中:NH4+、K+、ClO-、Cl-
B.有SO42—存在的溶液中:Na+、Mg2+、Ba2+、I-
C.加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br-
D.在含有大量[Al(OH) 4] -的溶液中:NH4+、Na+、Cl-、H+
难度: 中等查看答案及解析
-
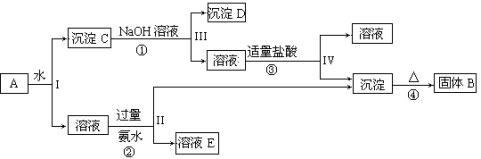
能符合如下图所示的转化关系的元素是

A.硅 B.硫 C.铜 D.铁
难度: 中等查看答案及解析