-
下列关于硅的说法不正确的是
A.硅是非金属元素,但它的单质是灰黑色,有金属光泽
B.硅的导电能力介于导体和绝缘体之间,是良好的半导体材料
C.加热到一定温度时,硅能与O2、Cl2等非金属单质反应
D.自然界存在游离态的硅
难度: 简单查看答案及解析
-
现代科技将
涂于飞机表面,可以吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。下面列出该原子核内中子数与核外电子数之差的数据正确的是
A.84 B.41 C.125 D.209
难度: 简单查看答案及解析
-
下列物质(或其主要成分)的化学式不正确的是
A.铝土矿 Al2O3 B.铜绿 Cu2(OH)2CO3
C.赤铁矿石 Fe2O3 D.苏打 NaHCO3
难度: 简单查看答案及解析
-
下列物质可用做半导体材料的是
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
难度: 简单查看答案及解析
-
下列叙述正确的是
A.玻璃是人类最早使用的硅酸盐材料
B.玻璃钢和光导纤维都是复合材料
C.制普通玻璃的原料是石灰石和黏土
D.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
难度: 简单查看答案及解析
-
某元素原子核外电子排布为:第二层上的电子数比第一层与第三层电子数之和的两倍还多2,该元素是
A.Na B.Mg C.Al D.Cl
难度: 简单查看答案及解析
-
已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为
A.A-x B.A-x-n C.A-x+n D.A+x-n
难度: 简单查看答案及解析
-
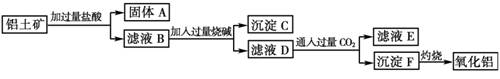
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.[Al(OH)4]- B.Cu2+ C.Al3+ D.Mg2+
难度: 简单查看答案及解析
-
下列试剂可用带玻璃塞的玻璃瓶存放的是
A.NaOH溶液 B.石灰水 C.盐酸 D.氢氟酸
难度: 简单查看答案及解析
-
下列各组元素性质递变情况错误的是
A.Li、Be、B 原子最外层电子数逐渐增多
B.P、S、Cl 最高正价依次升高
C.N、O、F 最高正化合价依次升高
D.Na、Mg、Al 的原子半径依次减小
难度: 简单查看答案及解析
-
某溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是
A.Ca2+、H+、Cl-、CO32- B.K+、Cl-、SO42-、[Al(OH)4]-
C.K+、OH-、SO32-、MnO4- D.H+、Al3+、Mg2+、Cl-
难度: 简单查看答案及解析
-
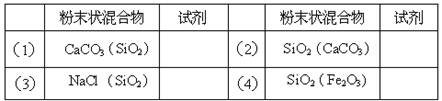
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
................... ①MgO ②Al2O3 ③Al(OH)3 ④Al ⑤Mg ⑥Mg(OH)2
A.①④⑤ B.③④⑥ C.②③⑤ D.②③④
难度: 简单查看答案及解析
-
下列指定微粒的个数比等于2:1的是
A.
H原子的中子数和质子数
B.
Ar原子中的质量数和中子数
C.
Be2+离子中的电子数和质子数
D.
Mg2+离子中的中子数和电子数
难度: 简单查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C
2AlN + 3CO↑
下列叙述不正确的是
A. 在氮化铝的合成反应中,N2是还原剂
B. 在氮化铝的合成反应中,C是还原剂
C. 氮化铝中氮元素的化合价为-3
D. 上述反应中每生成1molAlN,转移3 mol e-
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)可用于含碳化合物的结构分析,14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C60属于同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
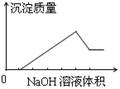
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 简单查看答案及解析
-
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
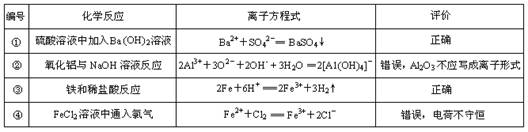
A.只有② B.①③ C.②④ D.①②③④
难度: 简单查看答案及解析
-
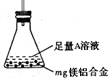
一定质量的镁铝合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的镁铝合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。则该合金中铝、镁的物质的量之比为
A.1︰1 B.2︰5 C.3︰2 D. 3︰5
难度: 简单查看答案及解析