-
可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
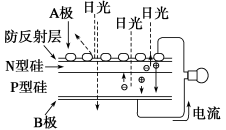
A.如上图是太阳能光伏发电原理图,图中A极为正极
B.风能、太阳能、生物质能等属于可再生能源
C.推广可再生能源有利于经济可持续发展
D.光伏发电能量转化方式是太阳能直接转变为电能
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
难度: 中等查看答案及解析
-
我国科学家首次合成的一种过渡金属的新核素Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点。185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
A.物质的量相等的185Hf与180Hf质量相同
B.核外电子数分别为108、113
C.1 mol 180Hf比1 mol 185Hf的中子数少5NA
D. 180Hf、185Hf在周期表中的位置不同
难度: 中等查看答案及解析
-
化学科学需要借助化学语言来描述,下列化学用语正确的是( )
A.NH4I的电子式
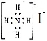
B.Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
C.钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比不同
D.Al2O3的化学键类型与AlCl3的化学键类型相同
难度: 中等查看答案及解析
-
下图为两种途径制备硫酸的过程,反应条件略。下列说法错误的是( )
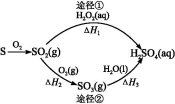
A.已知S(l)+O2(g)===SO2(g) ΔH=-293.23kJ·mol-1,则S(s)+O2(g)===SO2(g)反应放出的热量小于293.23 kJ/mol
B.含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均属于酸性氧化物
D.若ΔH1<ΔH2+ΔH3,则2H2O2(aq)
2H2O(l)+O2(g)为放热反应
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
①酸性:H2SO4>H3PO4 ②热稳定性:Na2CO3>NaHCO3 ③非金属性:Cl>Br
④熔点:H2O>H2S ⑤碱性:NaOH>NH3·H2O ⑥稳定性:H2O>H2S
⑦酸性:HI>HCl ⑧还原性:HI>HCl
A.①③⑥⑧ B.③④⑤⑥ C.②④⑤⑦⑧ D.②④⑤⑦
难度: 中等查看答案及解析
-
下列装置或实验操作正确的是( )
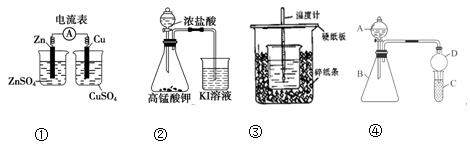
A.装置①:检验电流的方向
B.装置②:探究氧化性:KMnO4﹥Cl2﹥I2
C.装置③:测定中和热
D.装置④:A、B、C中分别加入HCl、Na2CO3、Na2SiO3判断Cl、C、Si的非金属性
难度: 中等查看答案及解析
-
下列电池工作时,O2在正极放电的是( )

难度: 简单查看答案及解析
-
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.X的氢化物H 2X晶体熔化、液态WX3气化均只需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点依次升高
B.NaHSO4晶体中阴、阳离子的个数是1∶2且熔化时破坏离子键和共价键
C.熔融状态下能导电的化合物一定含离子键
D.CS2、BF3分子中所有的原子均为8电子稳定结构
难度: 中等查看答案及解析
-
根据表中的信息判断下列说法正确的是( )

A.表示石墨燃烧热的热化学方程式为C(石墨,s)+
O2(g)═CO(g)△H=﹣393.5 kJ/mol
B.由表中信息知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol
C.由表中信息可得如图所示的图象
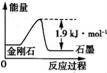
D.由表中信息可推知相同条件下金刚石的熔点高于石墨的熔点
难度: 中等查看答案及解析
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.若原子半径X>Y,则气态氢化物稳定性: HmX<HnY
B.X、Y一定不是同周期元素
C.由mXa-与nYb-得m+a=n-b
D.Xa-的还原性一定强于Yb-
难度: 中等查看答案及解析
-
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是( )
A.B与A只能组成化合物BA3
B.C、D、E形成的化合物与A、B、C形成的化学物可能发生氧化还原反应
C.A2C2和D2C2具有完全相同类型的化学键
D.E的最高价氧化物对应的水化物一定具有强的氧化性
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A.离子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均只有一种
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与过氧化氢分子相似。常温下,S2Cl2是一种橙黄色液体,与水能反应产生能使品红溶液褪色的气体。下列说法错误的是( )
A.S2Cl2的结构式为Cl—S—S—Cl
B.S2Cl2为含有极性键和非极性键的分子
C.S2Br2与S2Cl2结构相似,熔沸点S2Cl2>S2Br2
D.S2Cl2与水反应的方程式为:2S2Cl2 + 2H2O = SO2 + 3S↓ + 4HCl
难度: 中等查看答案及解析
-
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组
A -268.8
B -249.5
C -185.8
D -151.7
第二组
F2 -187.0
Cl2 -33.6
Br2 58.7
I2 184.0
第三组
HF 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 00.0
H2S -60.2
H2Se 42.0
H2Te -1.8
下列各项判断正确的是( )
A.第一组和第二组物质中一定含有共价键
B.第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se
C.第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D.第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强
难度: 中等查看答案及解析
-
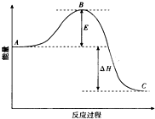
如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
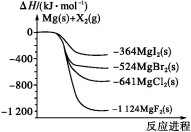
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.若2H2(g)+O2(g) =2H2O(g) ΔH= - 483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol
B.若P4(白磷,s) =4P(红磷,s) ΔH = -29.2kJ/mol,则红磷比白磷稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g) =2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
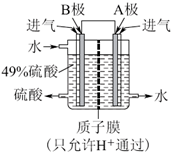
甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是( )
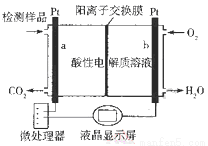
A.该装置为电能转化为化学能的装置
B.a电极发生的电极反应为CH3OH + H2O - 6e- ═ CO2↑ + 6H+
C.当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D.将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
难度: 中等查看答案及解析
-
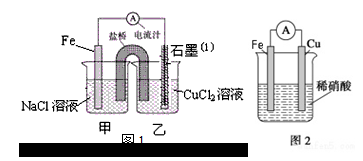
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
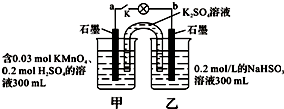
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯发生的反应为MnO4- + 3e- + 4H+ = MnO2 + 2H2O
D.乙池中的氧化产物为SO42-
难度: 中等查看答案及解析
-
A、B、C、D、E五种元素均为短周期元素,其原子序数依次增大。A元素原子的核外电子数、电子层数和最外层电子 数均相等;B、C、D、E四种元素在元素周期表中的相对位置如图I如示。另有甲、乙、M、W、X、Y、Z七种物质均由A、C、D 三种元素中的若干种组成(只有M中同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子中含有10个电子,它们之间的相互转化关系如图Ⅱ所示。请回答下列问题:

(1)用电子式表示乙的形成过程 ,Y的分子式为 ,W的结构式为 。
(2)反应④的化学方程式为 。
(3)工业上常用浓氨水检查E2的管道是否泄漏,反应的方程式为 。
(4)W—空气燃料电池是一种碱性燃料电池,电解质溶液是20%——30%的KOH溶液。该燃料电池的负极反应式为 。
难度: 困难查看答案及解析