-
化学与生活密切相关,下列对于生活中的化学说法正确的是
A. 服用阿司匹林出现水杨酸反应时,可服用NaOH溶液解毒
B. 爆竹爆炸后硫燃烧生成SO3,会造成硫酸型酸雨
C. 《本草纲目》中记载“火药乃焰消、硫磺、杉木炭所合,以烽燧铳机诸药者”,这里的焰消指的是KNO3
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质就变成了氨基酸
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol熔融的NaHSO4中含有的离子数目为NA
B. 12g金刚石中含有C-C键数目为4NA
C. 25℃时,Ksp(BaSO4)=1×10-10,则饱和BaSO4溶液中Ba2+数目为1×10-5NA
D. 1mol的Na2O和BaO2混合物中含有的阴、阳离子总数为3NA
难度: 困难查看答案及解析
-
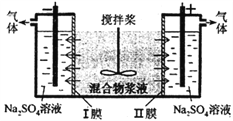
海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,
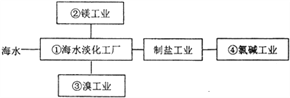
下列说法不正确的是
A. ①中可采用反渗透膜法,该法用到的半透膜可用于渗析操作
B. ②中工业上要制金属镁,可通过电解饱和氯化镁溶液的方法来获取
C. ③中提溴需要对含溴溶液加有机溶剂进行富集,该操作称为萃取
D. ④中氯碱工业电解饱和食盐水,采用的是阳离子交换膜法进行电解
难度: 中等查看答案及解析
-
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。预测的现象与实际不相符的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是
A. 中性溶液中:Na+、Fe3+、Cl-、SO42-
B. 含MnO4-的溶液中:H+、K+、Br-、I-
C. 0.1mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、NO3-
D. 由水电离出的c(OH-)=1×10-14 mol·L-1的溶液中:K+、Na+、SO42-、CO32-
难度: 困难查看答案及解析
-
某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
B. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
C. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
D. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++2OH-+SO42-+NH4++H+=NH3·H2O+BaSO4↓+H2O
难度: 困难查看答案及解析
-
短周期元素A、B、C、D、E的原子序数依次增大,A的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数;若往E单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中,正确的是
A. B的氢化物沸点一定高于A的氢化物沸点
B. 某物质焰色反应呈黄色,该物质一定是含C的盐
C. 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红
D. 氧化物水化物的酸性E大于B
难度: 困难查看答案及解析
-
用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断正确的是
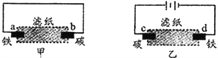
A. b、d两极附近均有气泡冒出
B. 甲乙中变红色的电极均发生了还原反应
C. a、d两极电极反应均为:Fe-2e-=Fe2+
D. 乙中铁棒比甲中铁棒更易腐蚀
难度: 中等查看答案及解析
-
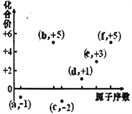
右图表示某可逆反应:N2(g)+3H2(g)
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
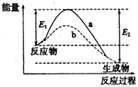
A. 反应物的总键能小于生成物的总键能
B. 如果对上述反应加压,平衡正向移动,△H减小
C. a与b相比,反应的平衡常数一定不同
D. a与b相比,a的反应速率更快
难度: 中等查看答案及解析
-
下列实验装置能达到实验目的的是
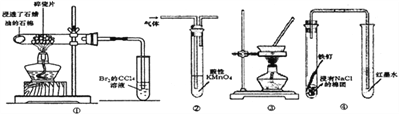
A. 图①装置验证石蜡油分解的产物是乙烯
B. 图②装置可用于检验SO2的漂白性
C. 图③装置可通过蒸干FeCl3饱和溶液制备FeCl3晶体
D. 图④装置可观察铁的吸氧腐蚀
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的如图所示,下列说法正确的是
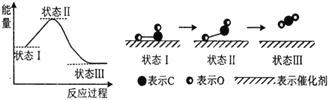
A. 状态I→状态III表示CO与O2反应的过程
B. CO和O生成了具有极性共价键的CO2
C. 在该过程中,CO断键形成C和O
D. CO和O生成CO2是吸热反应
难度: 中等查看答案及解析
-
从下列事实所列出的相应结论正确的是

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
聚合物锂离子电池是以Li+嵌入化合物为正、负极的二次电池。如图为一种聚合物锂离子电池示意图,其工作原理为LiNiO2+6C
Li1-xNiO2+LixC6,下列说法错误的是

A. 该电池充电可能引起电池正极发生金属锂沉积
B. 充电时当外电路通过1mole-时理论上由2molLi0.9C6转化为Li0.4C6
C. 电池放电时电解质的微粒Li+由负极向正极移动
D. 电池放电时正极的电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2
难度: 中等查看答案及解析
-
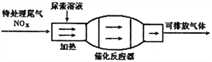
亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是

A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
难度: 中等查看答案及解析
-
将8.4g Fe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到30g Fe(NO3)2和Fe(NO3)3的混合物,将该固体隔绝空气在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中得到硝酸和NO,在标准状况生成NO气体的体积为
A. 1120mL B. 2240mL C. 3360mL D. 4480mL
难度: 困难查看答案及解析