-
下列元素中属于长周期主族元素的是
A. Li B. P C. Fe D. Br
难度: 中等查看答案及解析
-
下列电子式书写错误的是
A.
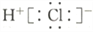 B.
B.  C.
C. D.
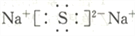
难度: 简单查看答案及解析
-
在如图所示的微粒中,结合电子能力最强的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列反应中属于吸热反应的是
A. 铝粉与氧化铁反应 B. 氯化铵晶体与氢氧化钡晶体反应
C. 锌片与稀硫酸反应 D. 钠与冷水反应
难度: 简单查看答案及解析
-
已知某离子的结构示意图为
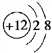 ,下列说法中正确的是
,下列说法中正确的是A. 该元素位于第二周期ⅡA族 B. 该元素位于第二周期Ⅷ族
C. 该元素位于第三周期零族 D. 该元素位于第三周期ⅡA族
难度: 简单查看答案及解析
-
下列变化中,不需要破坏化学键的是
A. 碘升华 B. 碳酸氢钠受热分解 C. 氯化氢溶于水 D. 氯化钠熔化
难度: 简单查看答案及解析
-
已知氢有3种核素[
H(H)、
H(D)、
H(T)],氯有2种核素(35Cl、37Cl),则氯化氢的相对分质量的数值最多有
A. 3种 B. 5种 C. 6 种 D. 10种
难度: 简单查看答案及解析
-
下列说法正确的是
A. 化学反应一定伴随着物质变化和能量变化 B. 化合反应都是放热反应
C. 绿色新能源是目前能源的主要形态 D. 生物质能是不可再生能源
难度: 简单查看答案及解析
-
河南省科学院宣布,用同位素锝(Tc)-99 给低产油田做“钡透”,能实现原油的增产增收。下列有关
Tc的说法中不正确的是
A.
Tc与
Tc互为同位素 B.
Tc与
Tc的质量相同
C.
Tc含有5 6个中子 D.
Tc的中子数比电子数多13 个
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 硫化氢通入CuSO4溶液中:H2S+Cu2++SO42-=CuS↓+H2SO4
B. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. 向CuSO4 溶液中加入NaOH:Cu2++2OH-=Cu(OH)2↓
难度: 简单查看答案及解析
-
下列排列顺序正确的是
A. 微粒半径:Mg2+>F- B. 稳定性:HI>HBr
C. 熔点:Al>Na D. 酸性:H2SiO3>H3PO4
难度: 简单查看答案及解析
-
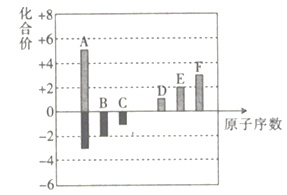
现有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为 A原子L层电子数的2倍。A和B分别是
A. Si和Na B. C 和 Al C. Cl和O D. B和He
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 5.6 g铁粉与过量稀HNO3反应时,转移的电子数为0.3NA
B. 标准状况下,2.24 L 由N2 和O2 组成的混合气体中所含的原子数为0.1 NA
C. 常温下,0.1mol Cl2溶于水时,转移的电子数是0.1 NA
D. 1L1.00mol·L-1NaCl溶液中NaCl分子数为NA
难度: 简单查看答案及解析
-
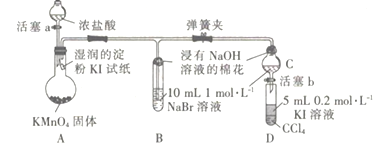
利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是

选项
甲
乙
__丙
装置丙中的现象
实验结论
A
稀硝酸
碳酸钾
澄淸石灰水
变浑浊
酸性:HNO3>H2CO3
B
稀硫酸
碳酸钠
次氯酸钙溶液
白色沉淀
酸性:H2CO3>HClO
C
浓盐酸
大理石
硅酸钠溶液
白色沉淀
非金属性:C>Si
D
浓盐酸
高锰酸钾
石蕊溶液
先变红后褪色
氯水既有酸性,又具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知有如下反应:①ClO3-+5Cl-+6H+=3Cl2↑+3H2O,②2FeCl3+2KI=2FeCl2+2KCl+I2,
③2FeCl2+Cl2=2FeCl3。下列说法正确的是
A. 反应①中氧化剂与还原剂的物质的量之比为5:1
B. 根据上述三个反可知氧化性:ClO3->Cl2>Fe3+>I2
C. 反应②中每生成127 g I2,转移的电子数为2NA
D. 反应②中FeCl3 只作氧化剂,反应③中FeCl3只是氧化产物
难度: 中等查看答案及解析
-
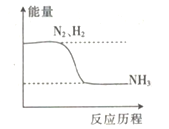
已知反应NO2(g)+CO(g)=NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是
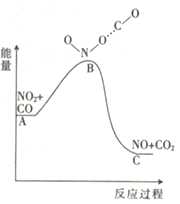
A. 图中A→B的过程为放热过程
B. 1molNO2和1molCO的键能总和大于1molNO和1mol CO2 的键能总和
C. 该反应为氧化还原反应
D. 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g) 和1mol CO2(g)的总能量
难度: 简单查看答案及解析