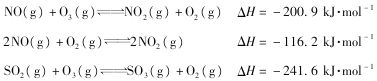-
化学与人类的生活、生产密切相关,下列说法中正确的是
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. “青蒿一握,以水二升渍,绞取之”,上述提取青蒿素的过程中发生了化学变化
C. 绿色化学的核心是应用化学原理对环境污染进行治理
D. 用浸泡过酸性KMnO4溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
难度: 中等查看答案及解析
-
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
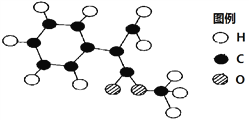
分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 简单查看答案及解析
-
下列操作会导致实验结果偏高的是
A. 中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B. 用标准NaOH溶液滴定未知盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗
C. 用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D. 配制一定物质的量浓度稀硫酸溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO
水解程度减小,溶液的pH减小
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
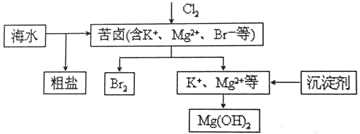
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
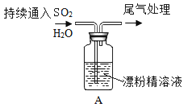
依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,并利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。

其中装置正确且能达到实验目的的组合是
A. ①②③④ B. ①②③ C. ②③ D. ②④
难度: 中等查看答案及解析
-
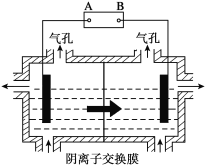
我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
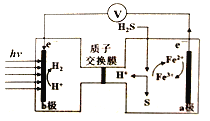
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
难度: 困难查看答案及解析
-
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是

A. 该有机物分子式为:C7H10O3
B. 该有机物所有质子可能在同—平面
C. 该有机物能发生取代、加成、氧化、还原反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项
实验操作
实验目的或结论
A
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
说明该钾盐是K2CO3
B
向含有少量FeCl3 的MgCl2 溶液中加入足量Mg(OH)2 粉末,搅拌一段时间后过滤
除去MgCl2 溶液中少量FeCl3
C
常温下,向饱和Na2CO3 溶液中加少量BaSO4 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
说明常温下,Ksp(BaCO3)<Ksp(BaSO4)
D
将亚硫酸钠与浓硫酸反应制得的气体通入品红溶液中使之褪色
可证明浓硫酸的强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4 溶液
均有固体析出
蛋白质均发生变性
B[
淀粉溶液和稀H2SO4混合加热后,再加新制的Cu(OH)2悬浊液煮沸
无砖红色沉淀产生
淀粉未水解
C
将乙醇和浓硫酸共热至170℃后,将生成的气体通入酸性KMnO4溶液中
KMnO4溶液褪色
证明乙烯能使KMnO4溶液褪色
D
将油脂与NaOH溶液共热,冷却后,加入食盐晶体。
混合物上层有固态物质析出
油脂发生了皂化反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性,已知:4FeO42﹣+10H2O⇌4Fe(OH)3+8OH﹣+3O2↑高铁酸钾常见制备方法之一是湿法制备:在一定条件下,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液.下列说法正确的是( )
A. K2FeO4在处理水的过程中所起的作用只有消毒杀菌
B. 同浓度的高铁酸钾在pH=ll.50的水溶液中比中性溶液中稳定
C. 湿法制备高铁酸钾,可以在酸性环境中顺利进行
D. 湿法制备高铁酸钾,Fe(NO3)3与NaClO物质的量之比为3:2
难度: 中等查看答案及解析
-
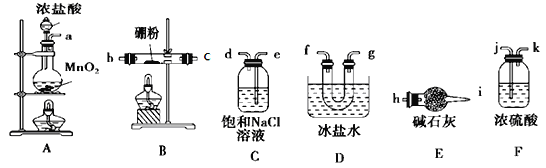
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-
H++B2-,则下列说法中一定正确的是
A. 在Na2B溶液中一定有:c(OH
)=c(H
)+c(HB
)+2c(H2B)
B. NaHB溶液可能存在以下关系:c(Na
)>c(HB
)>c(OH
)>c(H
)
C. NaHB水溶液中一定有:c(Na
)+c(H
)=c(HB
)+c(OH
)+c(B
)
D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
难度: 困难查看答案及解析
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×10-5
4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
则下列有关说法正确的是( )
A. 各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C. 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小
D. NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO
)+c(CO
)〕
难度: 中等查看答案及解析
-
有机物
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A. 19种 B. 9种 C. 15种 D. 6种
难度: 困难查看答案及解析
-
根据下列各图曲线表征的信息,得出的结论不正确的是
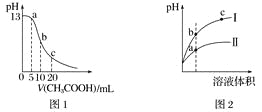

A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
难度: 困难查看答案及解析
-
将下图所示实验装置的K闭合,下列判断正确的是

A. Zn电极上发生还原反应
B. 片刻后盐桥中的Cl-向乙装置中移动
C. 当电路中有0.2mol电子转移时,甲池增重质量为6.5克
D. 电子的流动方向从Zn→a ; b→Cu
难度: 中等查看答案及解析
-
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是
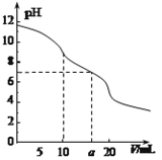
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32—)+c(HCO3-)+c(H2CO3)=c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32—)>c(H2CO3)
D. 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
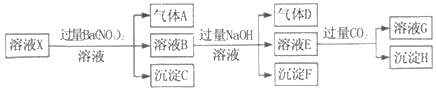
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L﹣1
难度: 困难查看答案及解析