-
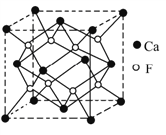
制备Fe3O4纳米颗粒的离子方程式为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 参加反应的氧化剂与还原剂的物质的量之比为1:5
C. 每生成1mol S4O62-转移4mol电子
D. 制备的Fe3O4纳米颗粒能发生丁达尔现象
难度: 中等查看答案及解析
-
生产、生活中应用下列物质时,不涉及氧化还原反应的是
A. 多吃水果(富含维生素 C)美容养颜
B. 钢铁在潮湿空气中发生吸氧腐蚀
C. 制作玻璃雕刻时使用氢氟酸
D. 食品袋内装有还原铁粉的小袋
难度: 简单查看答案及解析
-
下列叙述正确的是
A. CO2、SiO2、P2O5、NO均为酸性氧化物
B. 氯化铵、次氯酸均属于强电解质
C. 铝热剂、HD、液氨均为混合物
D. 溴乙烷、Fe(OH)3、FeCl2均可由化合反应制得
难度: 简单查看答案及解析
-
某有机物的结构如下图所示,下列说法正确的是
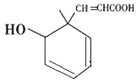
A. 分子式为C10H14O3
B. 与足量溴水反应后官能团数目不变
C. 可发生加成、取代、氧化、加聚等反应
D. 1mol该有机物可与2molNaOH反应
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-
CaCO3 ↓+H2O+CO2↑
B. 用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
C. NaClO溶液中通入少量的SO2:ClO-+H2O+SO2=Cl-+SO42-+2H+
D. 过氧化钠溶于水:2O22-+2H2O=4OH-+O2↑
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 18gD2O中含有的质子数为10NA
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C. 常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数目为0.2NA
D. 密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是
A.
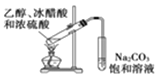 实验室制备乙酸乙酯 B.
实验室制备乙酸乙酯 B.  比较不同催化剂对化学反应速率的影响
比较不同催化剂对化学反应速率的影响C.
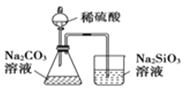 比较硫、碳、硅三种元素的非金属性 D.
比较硫、碳、硅三种元素的非金属性 D. 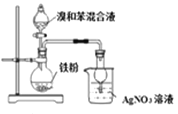 验证溴和苯发生取代反应
验证溴和苯发生取代反应难度: 中等查看答案及解析
-
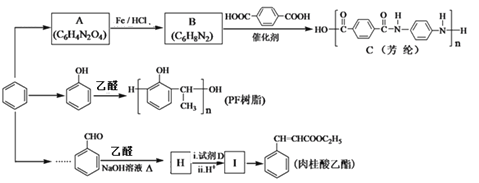
工业合成金刚烷的流程如下图所示。下列说法正确的是
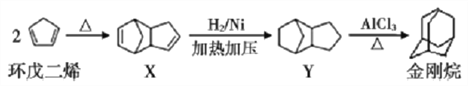
A. 环戊二烯分子中所有原子可能共平面
B. 环戊二烯生成X属于取代反应
C. 金刚烷的二氯取代物有3种
D. Y结构中含有3个5元环和1个6元环
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能使pH试纸显蓝色的溶液中:Na+、ClO-、Fe3+、SO42-
B. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
C.
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素, W元素的核电荷数为X元素的2倍。下列说法不正确的是

A. W、X、Y都存在既有极性键又有非极性键的氢化物
B. 与W同主族且位于其上一周期的元素形成的氢化物的沸点可能高于Y的氢化物
C. W分别与X、Y、Z形成的二元化合物都具有熔点高硬度大的特性
D. T元素的单质具有半导体特性
难度: 中等查看答案及解析
-
下列对于Cu及其化合物的说法正确的是
A. 在CuSO4溶液中加入H2S气体,溶液中酸性增强,说明酸性H2S大于H2SO4
B. 电解法精炼铜时,阴极析出的铜的质量与电路中通过电子没有确定关系
C. 向氯化铁溶液中加入适量氧化铜固体,可得到红褐色沉淀
D. 铜在潮湿空气中长时间放置,发生吸氧腐蚀,表面生成CuO
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
将光亮的镁条放入盛有NH4Cl 溶液的试管中
有大量气泡产生
反应中生成H2和NH3
B
将铜粉加入1.0mol·L-1Fe2(SO4)3溶液中
溶液变蓝
金属铁比铜活泼
C
淀粉溶液加稀硫酸、水浴加热一段时间后,加新制的 Cu(OH)2悬浊液,加热
有砖红色沉淀生成
淀粉水解后产生葡萄糖
D
将SO2气体通入滴有酚酞的NaOH溶液中
溶液褪色
SO2有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
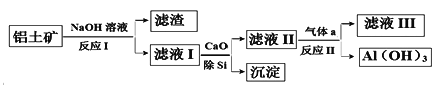
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
难度: 中等查看答案及解析
-
近日,中国科学院深圳先进技术研究院研发出一种高性能的钙离子电池:以溶有六氟磷酸钙Ca(PF6)2的碳酸酯类溶剂为电解液,放电时合金Ca7Sn6发生去合金化反应,阴离子(PF6−)从石墨烯中脱嵌,进入电解质溶液。放电时其工作原理如下图,下列说法错误的是(已知:比能量为单位质量的电极放出电能的大小)

A. 电池放电时,化学能转化为电能和热能
B. 放电时,a电极的电极反应方程式为:Ca7Sn6 —14e- =7Ca2+ + 6Sn
C. 充电时,b电极接电源的正极
D. 与锂离子电池相比较钙离子电池具有材料储量丰富、比能量高的优点
难度: 中等查看答案及解析
-
将1molCO和2molH2充入密闭容器中,发生反应:CO(g)+2H2(g)
CH3OH(g) △H。在其他条件相同时,测得CO平衡转化率[α(CO)]与温度和压强的关系如下图。
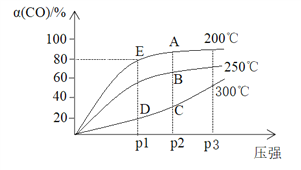
下列说法不正确的是
A. △H <0
B. C、D两点的反应速率:v(C)> v(D)
C. 若E点的容器体积为10L,该温度下的平衡常数为k=25
D. 工业生产中实际控制的条件200℃、P2压强,不采用P3的理由是,增大压强转化率变化不大,而且工业成本调高,得不偿失
难度: 中等查看答案及解析
-
25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是
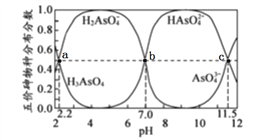
A. H3AsO4
H2AsO4-+H+的电离常数为10-2.2
B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)
C. 水的电离程度:a>b>c
D. HAsO4-的水解程度大于电离程度
难度: 中等查看答案及解析

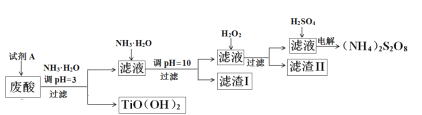
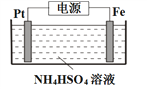
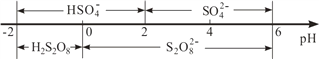
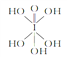 )和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).
)和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).