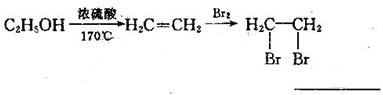-
2011年初,某媒体报道了“皮革奶”事件,不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量.下列说法不正确的是( )
A.动物皮革的主要成分是蛋白质
B.天然蛋白质水解的最终产物是α-氨基酸
C.皮革鞣制过程中使用的K2Cr2O7会使蛋白质盐析
D.“皮革奶”灼烧时有烧焦羽毛的气味难度: 中等查看答案及解析
-
下列说法正确的是( )
A.羟基的电子式为:
B.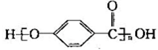 结构中含有酯基
结构中含有酯基
C.顺-2-丁烯和反-2-丁烯的加氢产物不同
D.HCO3-的水解方程式为:HCO3-+H2O⇌CO32-+H3O+难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑十+2H2O
C.向FeBr2溶液中通入过量的C12:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.用二氧化锰与浓盐酸反应制取Cl2:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
难度: 中等查看答案及解析
-
下列有关物质应用的说法不正确的是( )
A.氧化铁可用来制造红色油漆和涂料
B.二氧化硫可用来加工食品,使食品增白
C.硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂
D.浸泡过高锰酸钾溶液的硅土可用来延长果实或花朵的成熟期难度: 中等查看答案及解析
-
下列有关物质应用的说法不正确的是( )
A.含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA
B.常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA
C.1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA
D.一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA难度: 中等查看答案及解析
-
常温下,下列各组粒子在指定溶液中能大量共存的是( )
A.pH=l的溶液中:CH3CH2OH、Cr2O72-、K+、SO42-
B.NaHCO3溶液中: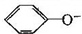 、CO32-、Br-、K+
、CO32-、Br-、K+
C.加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3-
D.C(Ca2+)=0.1 mol•L-1的溶液中:NH4+、SiO32-、CH3COO-、Br-难度: 中等查看答案及解析
-
下列实验装置及操作正确的是( )
A.制备乙酸乙酯
B.构成原电池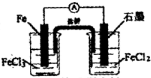
C.检验有无乙烯生成
D.检查装置气密性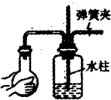
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性
B.粗锌与稀硫酸反应比纯锌快,说明粗锌反应时形成了原电池
C.向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅,说明BaCl2溶液有酸性
D.pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强难度: 中等查看答案及解析
-
香豆素是应用广泛的一种香料,它可以用水杨醛作原料合成.( )
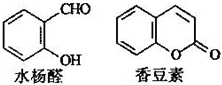
A.水杨醛和香豆素分子中均不含手性碳原子
B.水杨醛和香豆素分子中所有原子一定共平面
C.水杨醛和香豆素均能与溴水反应
D.水杨醛和香豆素各1 mol分别与足量的NaOH溶液反应,消耗NaOH的物质的量相等难度: 中等查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O
VO2++2H++V2+.下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.放电过程中,H+由正极移向负极难度: 中等查看答案及解析
-
下列实验的解释或结论不正确的是( )
选项 实验 解释或结论 A 用激光笔照射水玻璃溶液,有丁达尔现象 SiO32-水解生成硅酸胶体 B 在新制的氯水中加入碳酸钙粉末,充分搅拌 氯水中HClO的物质的量增加 C 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 Na2O2与H2O反应放热并有O2生成 D 向某溶液中加入稀盐酸,再加入硝酸钡溶液生
成白色沉淀原溶液中一定存在SO42-
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.25℃时,0.1 mol•L-1pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B.相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5O-)>c(Na2CO3)>c(NaOH)
C.常温下,将CH3COONa溶液、HCl溶液混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH)
D.0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3,溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3- )+c(H2CO3)+2c(H+)难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子;A与C,B与D均为同主族元素.下列叙述正确的是( )
A.在地壳中,B元素的含量位于第二位
B.A、B、D三种元素形成的化合物一定是强酸
C.A元素与C元素形成的化合物与水反应后,溶液呈碱性
D.B元素与C元素形成的化合物C2B和C2B2中阴、阳离子个数比均为1:2难度: 中等查看答案及解析
-
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,甲中充入2molA和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生反应:2A(g)+B(g)⇌2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )

A.达到平衡时,隔板K最终停留在刻度0与-2之间
B.若达到平衡时,隔板K最终停留在刻度-1处,则乙中C的转化率小于50%
C.若达到平衡时,隔板K最终停留在靠近刻度-2处,则乙中F最终停留刻度大于4
D.若图Ⅱ中x轴表示时间,则y轴可表示甲、乙两容器中气体的总物质的量或A的物质的量难度: 中等查看答案及解析
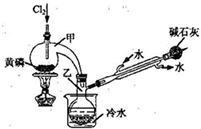

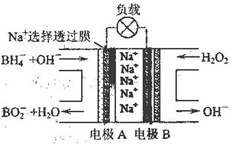
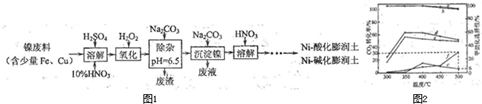
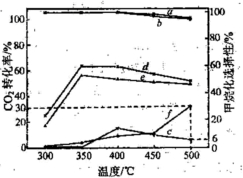

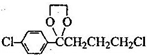 ),符合下列条件的G的同分异构体共有______种(不考虑立体异构).
),符合下列条件的G的同分异构体共有______种(不考虑立体异构).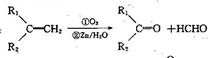
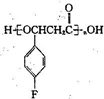 成路线流程图(无机试剂任选).
成路线流程图(无机试剂任选).