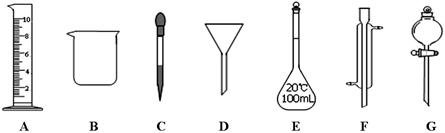
-
2012年“六·五”世界环境日中国主题为“绿色消费 你行动了吗?”,旨在强调绿色消费的理念,唤起社会公众转变消费观念和行为,节约资源能源,保护生态环境。下列有关绿色消费的说法不正确的是
A.提倡骑自行车或乘公交车上下班 B.将煤液化或气化,获得清洁燃料
C.推广使用无磷洗衣粉和无氟冰箱 D.提倡使用一次性木筷
难度: 简单查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法。下列关于“Na2CO3”的分类错误的是
A.Na2CO3俗名为纯碱,故它属于碱类 B.Na2CO3属于化合物
C.Na2CO3属于强电解质 D.Na2CO3属于含氧酸盐
难度: 简单查看答案及解析
-
胶体区别于其他分散系最本质的特征是
A.外观澄清透明 B.胶体有丁达尔效应
C.不稳定 D.分散质粒子直径在10-9--10-7m之间
难度: 简单查看答案及解析
-
现在,人们已经知道,原子是由原子核与核外电子构成的。不过,人类对原子结构的认识是逐渐深入的,下列哪位是最先发现电子的科学家
A.玻尔 B.卢瑟福 C.汤姆生 D.道尔顿
难度: 简单查看答案及解析
-
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A.
P B.
O C.
N D.
C
难度: 简单查看答案及解析
-
依据右图分析,下列叙述不正确的是
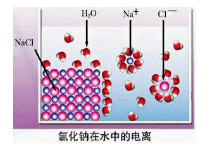
A.氯化钠是由钠离子和氯离子构成的
B.氯化钠的电离方程式为:NaCl =Na+ + Cl—
C.氯化钠的电离过程需要通电才能完成
D.氯化钠在水中形成能自由移动的水合钠离子和水合氯离子
难度: 简单查看答案及解析
-
下列实验操作或结论正确的是
A.在某溶液中加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定有Cl—
B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32—
C.做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验
D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A.Cu2+、C1—、Na+ B.H+、Cl—、CO32—
C.Ba2+、Na+、SO42— D.H+、K+、OH—
难度: 简单查看答案及解析
-
关于2mol二氧化碳的叙述中,正确的是
A.体积为44.8L B.质量为88g
C.分子数为6.02×1023 D.含有4mol原子
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是
A.铜丝 B.MgCl2 C.稀盐酸 D.蔗糖
难度: 简单查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
A.明矾常作为消毒剂
B.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂
C.高纯度的硅单质广泛用于制作光导纤维
D.钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
难度: 简单查看答案及解析
-
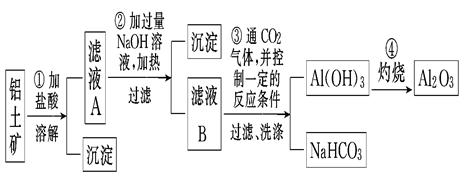
铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为
A.2∶1 B.3∶1 C.1∶1 D.1∶3
难度: 简单查看答案及解析
-
宁波博物馆于2008年12月5日建成开馆,该馆建筑形态以山、水、海洋为设计理念。宁波博物馆墙面通过两种方式装饰而成:第一种方式利用民间收集的上百万片明清砖瓦手工砌成瓦爿墙,另一种方式利用竹条加入混凝土,在表面展现竹的纹理,充分体现了建筑本身也是一件特殊的“文物”和“展品”;展品中陈列有大量宋代精美瓷器——青花瓷。下列说法错误的是

A.古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品
B.工业上制取水泥的主要原料为黏土、石灰石
C.博物馆窗户上普通玻璃的主要成分是SiO2
D.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式可表示为:Al2O3·2SiO2·2H2O
难度: 简单查看答案及解析
-
下列实验操作不正确的是
A.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
B.进行分液操作时,应将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准上口颈上的小孔,打开旋塞,使下层液体从漏斗颈下慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体从漏斗上口倒出
C.蒸发操作中,边加热边用玻璃棒搅拌,当加热至蒸发皿中有较多固体析出时,应停止加热,利用余热将液体蒸干
D.过滤操作中,滤纸边缘一定低于漏斗边缘,将玻璃棒靠在三层滤纸的边缘,将烧杯嘴靠在玻璃棒上,慢慢引流倒入液体
难度: 中等查看答案及解析
-
NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,下列有关说法正确的是
A.NaH中H的化合价为+1价,是氧化剂
B.在该反应中H2O 为还原剂
C.在该反应中NaH 为还原剂
D.该反应中电子转移的方向和数目可以表示为:

难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L H2O中含有的分子数为NA
B.32g O2中含有的分子数为NA
C.1 mol Al与足量O2反应转移的电子数为NA
D.1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为NA
难度: 简单查看答案及解析
-
下列离子方程式中,正确的
A.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
B.碳酸钙加入过量盐酸中:CO32—+2H+="==" CO2↑+H2O
C.氯气通入水中:Cl2 + H2O = Cl— + ClO— + 2H+
D.在CuSO4溶液中加入Ba(OH)2溶液:Ba2+ + SO42—= BaSO4↓
难度: 简单查看答案及解析
-
已知电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙。请你根据已学知识,按下图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是
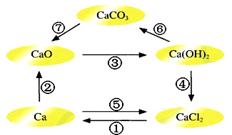
A.CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B.电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C.往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液都能实现反应⑥的转化
D.工业上可通过反应④往石灰乳中通入氯气生产漂白粉,所得漂白粉的主要成分为CaCl2
难度: 简单查看答案及解析
-
下表各选项中,通过置换反应不能实现由Y到W转化的一组化合物是
Y H2O SiO2 Fe2O3 Na2CO3
W NaOH CO Al2O3 NaHCO3
A. B. C. D.
难度: 困难查看答案及解析
-
下列实验现象与氧化还原反应有关的是
A.将点燃的镁条伸入充满二氧化碳的集气瓶中,观察到有白色固体生成,瓶壁上有黑色固体颗粒附着
B.“水玻璃”与空气中的二氧化碳接触,生成了乳白色的凝胶状沉淀
C.取少量溴水于试管中,再加入CCl4,振荡,静置后观察到液体分层,下层呈红棕色
D.用一定量的硫酸溶液进行导电性实验,发现灯泡较亮。向其中逐滴加入氢氧化钡溶液,发现灯泡亮度先逐渐变暗,后又逐渐变亮
难度: 中等查看答案及解析