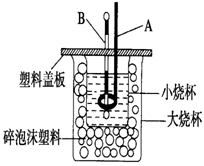
-
下列说法正确的是( )
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
难度: 中等查看答案及解析
-
形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
A.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
B.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
C.在农村推广使用沼气
D.减少资源消耗、增加资源的重复使用和资源的循环再生
难度: 简单查看答案及解析
-
250℃和1.01×105 Pa时,反应2N2O5(g)= 4NO2(g)+O2(g) ΔH=+56.76kJ/mol,自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.熵增效应大于能量效应 D.是熵减反应
难度: 中等查看答案及解析
-
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变为O3为放热反应
B.O3比O2稳定,由O2变为O3为吸热反应
C.O2比O3稳定,由O2变为O3为放热反应
D.等质量的O2比O3能量低,由O2变为O3为吸热反应
难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH—
2CO32— + 6H2O,则下列说法正确的是( )
A.构成该电池的正极和负极必须是两种活动性不同的金属
B.充电时每生成1 mol CH3OH转移6mol电子
C.充电时有CH3OH生成的电极为阳极
D.放电时电解质溶液的pH逐渐增大
难度: 中等查看答案及解析
-
随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是( )
A.利用电池外壳的金属材料
B.不使电池中渗泄的电解液腐蚀其他物品
C.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
D.回收其中石墨电极
难度: 简单查看答案及解析
-
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,一定能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
A.①③④ B.②④⑥ C、②⑤⑥ D、①③⑤
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,取一定量的A.B于反应容器中,当下列物理量不再改变时,表明反应A(s)+2B(g)
C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强 B.混合气体的密度
C.D的物质的量的比值 D.气体的总物质的量
难度: 中等查看答案及解析
-
下列反应达到平衡后,升高温度可以使混合气体平均相对分子质量增大的是( )
A.H2(g)+I2(g)
2HI(g) ΔH<0
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
C.N2(g)+3H2(g)
2NH3(g) ΔH<0
D.2SO3(g)
2SO2(g)+O2(g) ΔH>0
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.硫化钠水解 S2-+2H2O
H2S+2OH-
B.硫氢化钠的水解 HS-+H2O
H3O++S2-
C.不断加热煮沸氯化铁溶液 Fe3++3H2O
Fe(OH)3+3H+
D.硫酸铝溶液跟NaHCO3溶液反应 Al3++3HCO3-=Al(OH)3↓+3CO2↑
难度: 中等查看答案及解析
-
将H2和Br2充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)
2HBr(g) △H<0;平衡时Br2的转化率为a,若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b,则a与b的关系是( )。
A.a>b B.a=b C.a < b D.无法确定
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
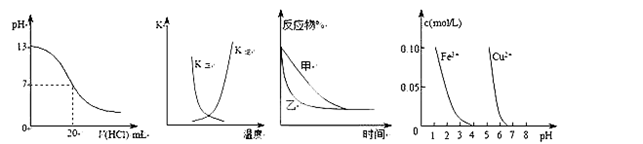
① ② ③ ④
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2A(g) + B(g)
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C.图③表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.C(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.CO32-可以大量共存的溶液:Na+、K+、NO3-、Al3+
D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3-
难度: 中等查看答案及解析
-
100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+) =10-10 mol·L-1,将pH=8的Ba(OH)2溶液V1L与pH=5,V2 L NaHSO4混合(忽略溶液体积变化),所得溶液pH=7,则V1:V2=( )
A.1:9 B.1:1 C.2:9 D.1:2
难度: 中等查看答案及解析
-
关于强弱电解质的叙述正确的是:( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.弱电解质的水溶液的导电能力比强电解质溶液弱
D.强电解质的稀溶液中无溶质分子,弱电解质的溶液中存在溶质分子
难度: 中等查看答案及解析
-
pH=2 的两弱酸HA.HB加水稀释后,溶液 pH随加水量的变化曲线如图所示。则下列叙述正确的是:( )

A.电离平衡常数HA > HB
B.等体积等pH的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积等pH的HA和HB 与等质量的Zn反应,HA反应速率大
D.若有等浓度的NaA.NaB,则碱性NaA>NaB
难度: 中等查看答案及解析
-
在一定条件下,Na2CO3溶液中存在水解平衡:CO32-+H2O
HCO3-+OH-,下列说法正确的是( )
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
C.升高温度,
减小 D.加入NaOH固体,溶液pH减小
难度: 中等查看答案及解析
-
下列说法合理的是( )
A.增加反应物的用量,化学反应速率一定加快
B.在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
C.难溶物A.B,KSP(A)>KSP(B),则溶解度S(A)>S(B)
D.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为碳酸钠
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)+C(H+)+C(NH4+)=C(SO42-)+C(OH-)
B.0.01 mol·L-1NaHCO3溶液中:C(Na+)>C(OH-)>C(HCO3-)>C(H+)
C.Na2CO3溶液中:C(OH-)= C(HCO3-)+2C(H2CO3)+ C(H+)
D.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa溶液等体积混合,溶液呈酸性:C(Na+)>C(CH3COOH) >C(CH3COO-)>C(H+)>C(OH-)
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.氯水中有平衡:Cl2+H2O
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
难度: 中等查看答案及解析
-
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:( )
Ca5(PO4)3OH(s)
5Ca2+(aq)+3PO43-(aq)+OH- (aq) Ksp = 6.8×10-37 mol9·L-9
下列说法错误的是( )
A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿
B.由上述平衡可知,小孩长牙时要少吃糖多补钙
C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大
D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)[Ca5(PO4)3F(s)的Ksp = 2.8×10-61 mol9·L-9]
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)
R(g)+2 L( ?),反应符合下图。下列叙述正确的是( )

A.T2>T1,正反应放热,L是液体
B.P2<P1,正反应吸热,L是固体
C.T2<T1,正反应放热,L是气体
D.P2>P1,正反应吸热,L是气体
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比为2:1
C.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
D.pH=2与pH=1的硝酸中c(H+)之比为1:10
难度: 中等查看答案及解析
-
右图是一电池,下列有关说法正确的是

A.该电池负极反应为:2Fe2+-2e-
2Fe3+
B.当有6.02×1023电子转移时,Fe电极减少56g
C.石墨电极上发生氧化反应
D.盐桥中K+移向FeCl3溶液
难度: 中等查看答案及解析
-
等物质的量浓度的下列四种溶液中,
浓度最大的是( )
A.NH4Cl B.NH4HCO3 C.NH4NO3 D.NH4HSO4
难度: 中等查看答案及解析