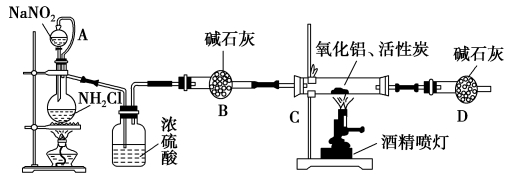
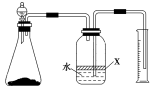
-
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用
B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质
C.大肠杆菌分子中不一定含羧基和氨基
D.出血性大肠杆菌和油脂均为能水解的高分子化合物
难度: 简单查看答案及解析
-
下列有关说法中不正确的是
A.将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀
B.高纯硅常用作光导纤维的原料
C.用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好
D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快
难度: 简单查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
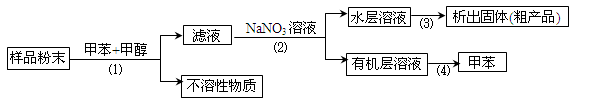
下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 简单查看答案及解析
-
一种从植物中提取的天然化合物α-damascone可用于制作“香水”,
其结构为:
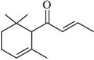 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是A.分子式为C13H20O
B.该化合物可发生聚合反应
C.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
D.1 mol该化合物完全燃烧消耗19 molO2
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===
+2H2O+
B.硫化钠的水解反应:S2-+2H2O
H2S+2OH-
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合
+Ba2++OH-===BaCO3↓+H2O
D.单质铜与稀硝酸反应:Cu+2H++
===Cu2++2NO↑+H2O
难度: 中等查看答案及解析
-
下列实验装置设计与对应结论正确的是
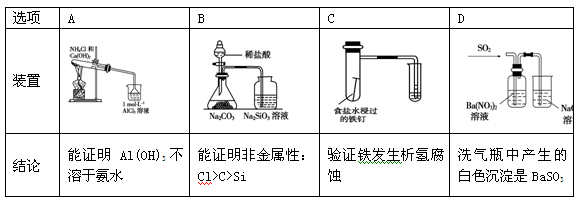
难度: 简单查看答案及解析
-
下列有关溶液的说法正确的是
A.向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7
B.实验测定,NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3
C.NH4Cl溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH-)
D.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.使酚酞试液变红的溶液中:S2-、
、
、Na+
B.由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、
、
、K+
C.pH=0的溶液中:Na+、K+、Fe2+、
D.pH=7的溶液中:Al3+、Cl-、
、
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应4 min时,若HCl浓度为0.12 mol·L-1,则H2反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
难度: 中等查看答案及解析
-
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
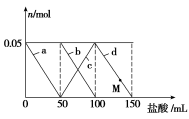
A.a曲线表示的离子方程式为:
+H++H2O===Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.原混合溶液中的
与
的物质的量之比为1∶2
D.M点时,溶液中沉淀的质量为3.9 g
难度: 困难查看答案及解析
-
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s
0
5
15
25
35
n(A)/mol
1.0
0.85
0.81
0.80
0.80
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
难度: 中等查看答案及解析
-
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是
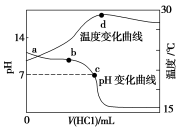
A.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
B.将此氨水稀释,溶液的导电能力减弱
C.c点时消耗盐酸体积V(HCl)<20 mL
D.室温下,a点的氨水电离常数为
mol·L-1
难度: 中等查看答案及解析
-
实验法和比较法是研究物质性质的基本方法。以下实验设计中不合理或不严密的是
A.钠和镁分别与冷水反应,判断钠和镁的金属性强弱
B.测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸
C.铁分别与氯气和硫反应,判断氯气与硫的氧化性强弱
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
难度: 简单查看答案及解析
-
下列判断中,正确的是
A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D.A、C、D的含氧酸的钠盐水溶液可能均显碱性
难度: 中等查看答案及解析
-
有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
A.在熔融电解质中,O2-由正极移向负极
B.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷
C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑
D.通入空气的一极是正极,电极反应式为O2+4e-===2O2-
难度: 中等查看答案及解析

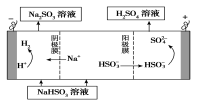
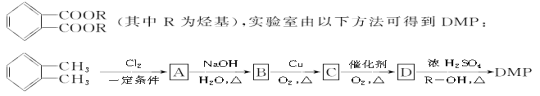
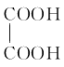 )在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。
)在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。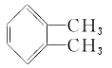 )为原料先生产苯酐(
)为原料先生产苯酐(