-
化学与生活密切相关,下列有关说法错误的是( )
A. 用菜籽油浸泡花椒制得花椒油的过程主要利用其物理性质
B. 卤水点豆腐是Mg2+、Ca2+等使蛋白质胶体发生聚沉的过程
C. 热的纯碱溶液可用于除去金属表面的矿物油(如机油、润滑油等)
D. 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜
难度: 简单查看答案及解析
-
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是常见大气污染物。下列有关判断不正确的是( )
A. 简单氢化物的热稳定性:C B. A、C、D的含氧酸的钠盐水溶液均显碱性
C. 单质B可用于铁轨的焊接 D. 最高价氧化物对应水化物的酸性:D>C
难度: 中等查看答案及解析
-
三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是( )
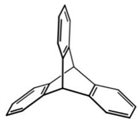

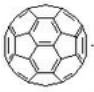
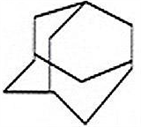
①(三碟烯) ②(扭曲烷) ③(富勒烯) ④(金刚烷)
A. ①③均能发生加成反应 B. ①④互为同分异构体
C. ①②③④均属于烃 D. ①②③④的一氯代物均只有一种
难度: 中等查看答案及解析
-
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
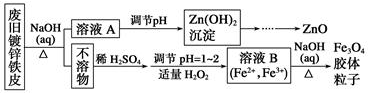
己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是( )
A. 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层
B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO
C. 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化
D. Fe3O4胶体粒子能用减压过滤法实现固液分离
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是( )
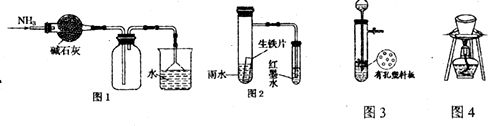
A. 图1所示的装置可用于干燥、收集并吸收多余的氨气
B. 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀
C. 图3所示装置用于Cu和浓H2SO4反应制取少量的SO2气体
D. 图4所示装置用于除去碳酸氢钠固体中的少量碳酸钠
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是
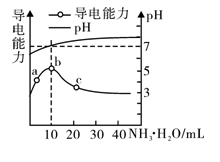
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
难度: 中等查看答案及解析
-
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示
意图如下,下列说法正确的是
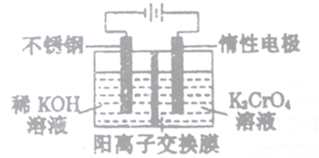
A. 在阳极室,通电后溶液逐渐由橙色变为黄色
B. 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g
C. 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA
D. 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
难度: 困难查看答案及解析


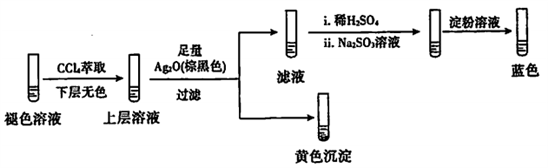
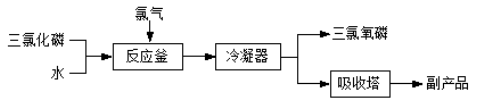
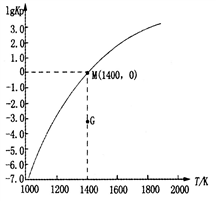
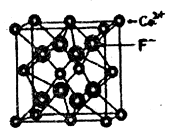
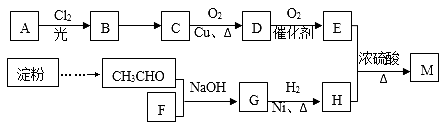 已知:
已知: