-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-难度: 中等查看答案及解析
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措,下列做法违背发展低碳经济的是( )
A.发展氢能和太阳能
B.尽量用纯液态有机物代替水作溶剂
C.提高原子利用率,发展绿色化学
D.限制塑料制品的使用难度: 中等查看答案及解析
-
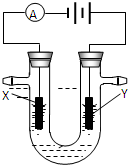
下列能达到实验目的是( )
A.
作为安全瓶防止倒吸
B.
喷泉实验
C.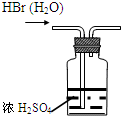
干燥HBr
D.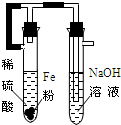
制取Fe(OH)2难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍难度: 中等查看答案及解析
-
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
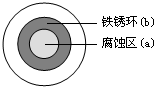
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-═Cu2+难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.N2的电子式:
B.邻羟基苯甲酸的结构简式:
C.S2-的结构示意图:
D.质子数为53,中子数为78的碘原子:53131I难度: 中等查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
下列说法正确的是( )反应时间/min n(CO)(mol) H2O(mol) 1.20 0.60 t1 0.80 t2 0.20
A.反应在t1min内的平均速率为
B.反应在t1min时没有达平衡,t2min时达到平衡
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应难度: 中等查看答案及解析