-
下列在理论上可设计成原电池的化学反应是( )
A. C(s)+H2O(g)=CO(g)+H2 (g)
B. Ba(OH)2•8H2O(s)+2NH4C1(s)=BaCl2(aq)+2NH3•H2O(l)+8H2O(l)
C. C(s)+CO2(g)=2CO(g)
D. CH4(g)+2O2(g)→CO2(g)+2H2O(l)
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键
A. ①③⑤ B. ②④⑥ C. ①②③⑤ D. ①③⑤⑥
难度: 中等查看答案及解析
-
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )
(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂
A. (1)(2) B. (2)(5) C. (3)(5) D. (4)(6)
难度: 困难查看答案及解析
-
下列有关化学用语表示正确的是( )
A. N2的电子式:
B. S2-的结构示意图:
C. NH4Br的电子式:
D. 原子核内有l8个中子的氯原子:
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H="+185.57" kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
难度: 简单查看答案及解析
-
如图是元素周期表的一部分,下列关系正确的是( )
S
Cl
Se
Br
A. 还原性:Se2->S2->Cl- B. 热稳定性:HCl>H2Se>HBr
C. 原子半径:Se>Cl>S D. 酸性:HBrO4>HClO4>H2SO4
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
难度: 中等查看答案及解析
-
已知一定温度下,下列反应的平衡常数:H2(g)+S(s)
H2S(g) K1,
S(s)+02(g)
SO2(g) K2。则相同温度下反应H2(g)+SO2(g)
O2(g)+H2S(g)的
平衡常数为( )
A. K1+K2 B. K1-K2 C. K1·K2 D. K1/K2
难度: 中等查看答案及解析
-
已知反应:3A(g)+B(g)
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
施是( )
①增大A的浓度 ②升高温度
③增大D的浓度④加入催化剂
⑤恒温下,缩小反应容器的体积
⑥加入稀有气体,保持容器内压强不变
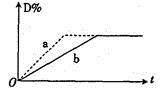
A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
难度: 中等查看答案及解析
-
在密闭容器内充入4 mol S02和3mol 02,在一定条件下建立平衡:
2SO2(g)+02(g)
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
则在此条件下反应放出的热量为( )
A. 1.8Q kJ B. 2Q kJ C. Q kJ D. 0.9 QJ
难度: 中等查看答案及解析
-
下列关于反应热的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B. 由C(石墨,s)——C(金刚石,s)△H=+1.9 kJ•mol-1可知,石墨比金刚石更稳定
C. 在500℃、MPa下,将0.5 mol N2和l.5 mol H2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6 kJ•mol-1
D. 甲烷的燃烧热(△H)为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)
CO2(g)+2H2O(g) △H=-890.3 kJ•mol-1
难度: 中等查看答案及解析
-
在一定条件下,可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,达到平衡后,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C. 降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D. 加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
难度: 简单查看答案及解析
-
针对下面四套实验装置图,下列说法正确的是

A. 用图1装置电解精炼镁 B. 用图2装置验证试管中铁丝发生析氢腐蚀
C. 图3装置中Mg作负极,Al作正极 D. 用图4装置对二次电池进行充电
难度: 中等查看答案及解析
-
对于可逆反应:2M(g)+N(g)
2P(g) △H<0,下列各图中正确的是( )
A.
 B.
B. 
C.
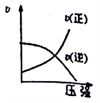 D.
D. 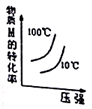
难度: 中等查看答案及解析
-
处理燃烧产生的烟道气CO和SO2,方法之一在一定条件下将其催化转化为CO2和S。己知:①2CO(g)+O2(g)= 2CO2(g) △H =-566.0 kJ/mol ②S(s)+O2(g)=SO2(g) △H=-296.0 kJ/mol 下列说法中正确的是( )
A. 可用澄清的石灰水鉴别CO2与SO2
B. 转化②中S和O2属于不同的核素
C. 转化①有利于碳参与自然界的元素循环
D. 转化的热化学方程式是:2CO(g)+SO2(g)=S(s)+2CO2(g) △H=+270kJ/mol
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛的应用。已知镍镉电池的电解质溶液是KOH溶液,放电时的电池反应是:Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2,下列说法正确的是
A. 放电时电解质溶液的密度减小 B. 放电时K+向Cd极区移动
C. 充电时阳极Cd元素被氧化 D. 充电时阴极附近的pH增大
难度: 中等查看答案及解析
-
半导体工业用石英砂作原料通过三个重要反应生产单质硅。
①SiO2(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g) △H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)═SiCl4(l) △H2=-657.01kJ•mol-1
③SiCl4(l)+2Mg(s)═2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为
A. 24372.86 kJ B. 21.44 kJ C. 600.20 kJ D. 21435.71 kJ
难度: 简单查看答案及解析
-
如图中的曲线是表示其他条件一定时,2NO(g)+O2(g)
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是

A. a点 B. b点 C. c点 D. d点
难度: 中等查看答案及解析
-
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是( )
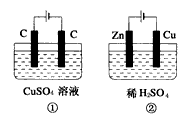
A. 产生气体的体积:(1)>(2)
B. 溶液PH的变化:(1)增大,(2)减小
C. 电极上析出物质的质量:(1)>(2)
D. 电极反应式:(1)中阳极:40H--4e-=2H2O+O2↑(2)中负极:2H++2e-=H2↑
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)
MgO(S)+CO2(g)+SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )

选项
x
y
A
SO2的浓度
平衡常数K
B
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
D
MgSO4的质量(忽略体积)
CO的转化率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
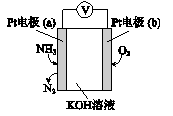
A. 溶液中OH-向电极a移动
B. 反应消耗的NH3与O2的物质的量之比为4:3
C. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
D. 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a
难度: 困难查看答案及解析