-
下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A. 天然气、明矾、液态空气 B. 稀有气体、浓硫酸、胆矾
C. 水银、熟石灰、水煤气 D. 金刚石、大理石、铁矿石
难度: 简单查看答案及解析
-
(NH4)2Fe (SO4)2·6H2O俗称摩尔盐,工业用途广泛。该化合物中 N、Fe、S 三种元素的化 合价分别是( )
A. -3、+3、+4 B. -3、+2、+6
C. +3、+3、+6 D. -3、+2、+4
难度: 简单查看答案及解析
-
设计对比实验,控制变量是学习化学的重要方法,下列对比实验不.能.达到目的的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学上用符号“
”表示原子的组成,其中 X 代表元素符号,Z 表示原子核内的质子数,A 表示原子核内质子数与中子数之和。已知abXn+和cdYm-的电子层排布完全相同,则下列关系正确的是( )
A. b-a=d-c B. a+n=c-m C. b-n=d+m D. a-n=c+m
难度: 简单查看答案及解析
-
图 1 所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录下来。图 2、图 3 是用该装置测得的红磷和木炭分别在集气 瓶中燃烧的压强-时间关系图(该装置气密性良好,p0 是集气瓶内初始压强,p 和 p′分别是反应结束后恢复到室温时集气瓶内的压强)。下列说法不正确的是( )


A. 燃烧匙内所装红磷或木炭的多少对实验结果无影响
B. 反应开始时集气瓶中压强瞬间变大是由燃烧放热造成的
C. p≈0.79p0,p′≈p0 是由反应前后气体体积变化造成的
D. 只可根据图 2 推出空气中氧气的含量
难度: 简单查看答案及解析
-
相同质量的锌片和铁片,分别与足量的稀硫酸充分反应(杂质不与稀硫酸反应),得到相 同质量的氢气,可能的结论是( )
A. 锌片是纯净物,而铁片不是 B. 铁片是纯净物,而锌片不是
C. 上述情况都不可能 D. 无法判断
难度: 简单查看答案及解析
-
有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH 溶液、稀硫酸 7 种物质,常温下两 种物质间能发生的化学反应最多有( )
A. 5 个 B. 6 个 C. 7 个 D. 8 个
难度: 中等查看答案及解析
-
下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是( )
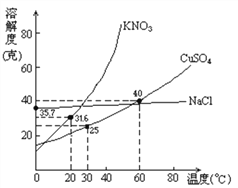
A. 20℃时,硝酸钾饱和溶液的质量分数是 31.6%
B. 40℃时,35g 氯化钠溶于 100g 水中,降温至 0℃时,可析出氯化钠晶体
C. 30℃时,将 35g 硝酸钾和 35g 氯化钠同时溶于 100g 水中,蒸发时先析出的是氯化钠
D. 60℃时,200g 水中溶解 80g 无水硫酸铜达饱和,降温至 30℃,可析出 30g 硫酸铜晶体
难度: 简单查看答案及解析


