-
我国著名化学家侯德榜先生,为世界纯碱工业技术的发展做出了杰出贡献。该法以NaCl、NH3、CO2等为原料,先制得NaHCO3,进而生产出纯碱。有关化学反应为:
NH3+CO2+H2O═NH4HCO3
NH4HCO3+NaCl═NaHCO3↓+NH4Cl
2NaHCO3══Na2CO3+CO2↑+H2O
Ⅰ.(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是_____。
a.NaHCO3难溶于水
b.NH4Cl难溶于水
c.NaHCO3的溶解度相对较小,在溶液中首先结晶析出
d.NH4Cl的溶解度相对较小,在溶液中首先结晶析出
(2)某活动小组根据上述原理,模拟碳酸氢钠的制备实验:将二氧化碳气体通入氨化的饱和食盐水中制备碳酸氢钠,实验装置如下图所示。

说明:(1)图中夹持、固定用的仪器未画出
(2)“氨化的饱和食盐水”就是向饱和食盐水中通入氨气至饱和
请回答:
①上图装置中有一处不合理,应如何更正_____________;活动小组合理更正装置后,加入试剂进行实验。
②实验结束后,分离出NaHCO3晶体的操作是_____(填操作的名称);
③实验时,为提高二氧化碳的吸收量,须向饱和食盐水中先通入NH3至饱和的原因是______;
Ⅱ.该法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(图中夹持、固定用的仪器未画出)。

实验步骤如下:
①按上图连接装置,并检查气密性;
②准确称得盛有碱石灰(氢氧化钠和氧化钙的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
请回答:
(1)鼓入空气的目的是____________,装置A中试剂X的溶质最适宜选用______(填化学式);
(2)若没有C装置,则会导致测定结果_____(填“偏大”、“偏小”或“不影响”);
(3)根据实验中测得的有关数据,纯碱样品中碳酸钠的质量分数为_____(用百分数表示,结果保留一位小数)。
-
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,该方法是以从海水中提取出来的食盐为主要原料制取纯碱。其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl; ②2NaHCO3 Na2CO3+X+CO2↑;
Na2CO3+X+CO2↑;
试回答下列问题:

(1)在反应①的六种物质中,能治疗胃酸过多的是 (填化学式)。
(2)在反应②中物质X的化学式是 。
(3)氯化钠和碳酸钠的溶解度曲线如图2,t1℃时,氯化钠饱和溶液溶质的质量分数 碳酸钠饱和溶液溶质的质量分数(填“大于”“小于”“等于”之一)。
(4)t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的 (填物质名称)加入烧杯内的水中,小试管内的固体物质会逐渐溶解。
(5)当Na2CO3固体中含有少量NaCl时,可采用降温结晶的方法提纯Na2CO3,请说明提纯的原理: 。
-
侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展做出了杰出贡献。工业上以半水煤气(主要成分是N2、H2、CO2)、食盐等为原料制取纯碱,相关流程如下:
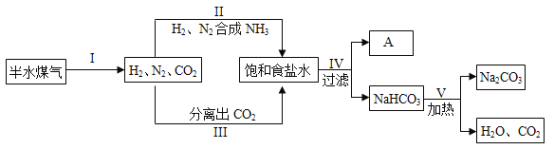
(1)流程中循环利用的物质有H2O和_____(写化学式)。
(2)请写出步骤Ⅴ中的化学反应方程式_____。
(3)已知A为铵态氮肥,请推断该物质为_____(写化学式)。
(4)侯氏制碱法制取纯碱过程中部分物质的溶解度曲线如下,试回答下列问题:
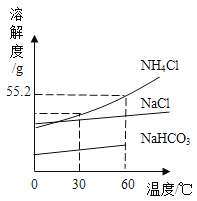
①60℃时,27.6gNH4Cl完全溶解至少需要_____g水。
②从图中可以看出温度高于60℃,NaHCO3的溶解度曲线“消失”了,原因是_____。
③结合上述化学反应方程式和物质的溶解度曲线回答,在氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵中,先结晶析出的物质是_____(填物质名称)。
-
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;

试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是________;
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是________.
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数________碳酸钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:.
-
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;

试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是________;
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是________.
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数________碳酸钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:.
-
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3
 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是________;
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是________.
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数________碳酸钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:________.

-
我国科学家侯德榜创立候氏制碱法为纯碱和化肥工业的发展做出了杰出贡献。下图1是候氏制碱法的反应原理,图2是相关物质的溶解度曲线,请结合图示回答下列问题:
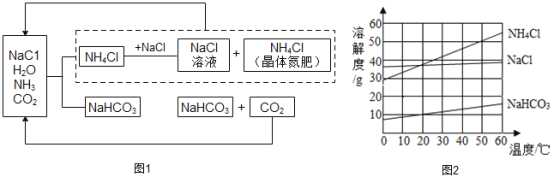
(1)制碱的主要反应原理:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3,生成的碳酸氢钠和氯化铵哪种物质首先析出?_______;理由是_______;
(2)该过程中除水外.能够循环利用的物质是_______;
(3)写出NaHCO3→Na2CO3 反应的化学方程式____________;
(4)50°C时,向100g水中加入55g氯化铵充分搅拌,所得溶液为____(填“饱和”或“不饱和”)溶液;
(5)60°C时,向等质量的氯化钠、碳酸氢钠、氯化铵中,分别加人水配成饱和溶液,所得溶液的质量由小到大的顺序是_______。
-
材料一:候德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。下面是实验室模拟侯氏制碱法原理的生产过程:

①20℃时,将CO2通入含NH3的饱和NaCl溶液中,生成 NaHCO3晶体和NH4Cl溶液。
②将①中的产物 NaHCO3晶体充分加热分解,得到Na2CO3、H2O和CO2。
材料二:20℃时几种物质在水中的溶解度/g
| NaCl | NH4Cl | NaHCO3 |
| 36.0 | 37.2 | 9.6 |
请回答下列问题:
(1)在第①步反应中,有 NaHCO3晶体析出,而没有NH4Cl和NaCl晶体析出的原因是_____。
(2)该生产过程中部分生成物可作为原料循环使用的是_____,同时得到的副产品NH4Cl是一种氮肥。
-
1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl
②2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(1)侯氏制碱法所制的“碱”是指________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是________(填物质名称)晶体。
(3)现有Na2CO3和NaCl的混合物样品22.3 g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:

①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为________(写化学式)。
②在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量________(计算结果精确至0.1 g)。
-
1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl
②2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(1)侯氏制碱法所制的“碱”是指________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是________(填物质名称)晶体。
(3)现有Na2CO3和NaCl的混合物样品22.3 g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:

①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为________(写化学式)。
②在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量________(计算结果精确至0.1 g)。











