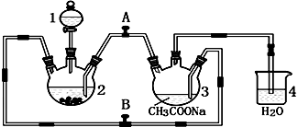
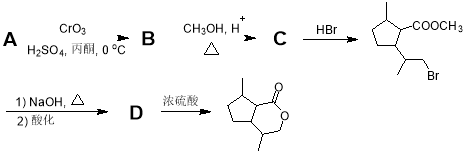
-
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
难度: 中等查看答案及解析
-
下列实验的操作、现象和结论均正确的是
选项
实验操作
实验现象
实验结论
A
NaHCO3溶液与NaAlO2溶液混合
生成白色沉淀
结合H+的能力:
CO32-<AlO2-
B
常温下,相同的铝片分别投入足量的稀、浓硫酸中
浓硫酸中铝片先溶解完
反应物浓度越大,反应速率越快
C
向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热
未出现砖红色沉淀
有机试剂X中不含醛基
D
2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液
白色沉淀转化为红褐色沉淀
溶解度:
Mg(OH)2>Fe(OH)3
难度: 困难查看答案及解析
-
以下数值大于或等于阿伏加德罗常数的是
A.6g石墨中的共价键数目
B.常温常压下,17g ND3中所含分子数目
C.0.1mol羟基(—OH)中所含电子数目
D.向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉
淀完全溶解,消耗的OH-数目
难度: 中等查看答案及解析
-
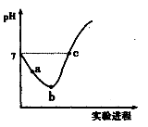
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.由a点到b点的过程中,溶液中C(H+)/ C(ClO-)减小
D.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
难度: 困难查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲的L层电子数是K层的3倍,丁所在族序数是周期数的2倍,乙、丙、丁的最外层电子数之和为10。下列说法正确的是
A.简单离子半径:乙>丙>丁
B.最高价氧化物对应的水化物的碱性:乙>丙
C.简单气态氢化物稳定性:丁>甲
D.甲和丁组成的化合物在熔融状态下可以导电
难度: 中等查看答案及解析
-
下列表示溶液中发生反应的方程式错误的是
A.100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:
CO32- + CH3COOH=HCO3- + CH3COO-
B.4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:
4AlO2- + 7H+ + H2O=3Al(OH)3↓+ Al3+
C.向HCOOK和KOH的混合溶液中加入KMnO4
2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
D.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:
5PbO2 + 2Mn2+ + 4H+=5Pb2+ + 2MnO4- + 2H2O
难度: 困难查看答案及解析