-
我国三峡工程所提供的清洁、可再生的水电相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
难度: 中等查看答案及解析
-
下面的能源中均属于二次能源的是( )
A.电能、风能 B.电能、蒸汽 C.蒸汽、风能 D.煤、石油
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 中等查看答案及解析
-
下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,稀硫酸 B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸 D.铜片、银片,FeCl3溶液
难度: 中等查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是( )
A.CH4,H2O2,NH3 B.H2O,CO2,Na2O2
C.Na2O,NaCl,MgCl2 D.NaOH,NaClO,Na2O
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
①锌粒与稀H2SO4反应制取H2 ②氢气在氧气中燃烧 ③碳酸钙高温分解成氧化钙和二氧化碳 ④氢氧化钾和硫酸中和 ⑤Ba(OH)2·8H2O与NH4Cl反应 ⑥氢气还原氧化铜 ⑦葡萄糖在人体内氧化分解 ⑧钢铁制品生锈的反应
A.①②③④ B.③⑤⑥ C.③⑤⑥⑦ D.①②④⑧
难度: 中等查看答案及解析
-
下列溶液中不能区别SO2和CO2气体的是( )
①石灰水 ②酸性KMnO4溶液 ③溴水 ④用硝酸酸化的Ba(NO3)2溶液 ⑤品红溶液
A.①②③⑤ B.②③④⑤ C.只有① D.①②
难度: 中等查看答案及解析
-
下列说法正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键 ②两种不同非金属元素原子间形成的化学键都是极性键 ③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高 ④难失去电子的原子,易形成阴离子 ⑤单质分子中不存在化学键,化合物的分子中才存在化学键 ⑥离子化合物中一定含有离子键
A.只有②⑥ B.只有①⑥ C.只有⑥ D.只有①④⑥
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表:下列叙述正确的是 ( )
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z从其氢化物中置换出来
难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如有图所示。以下有关该原电池的叙述正确的是( )
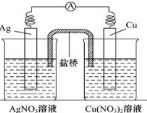
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-===Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl
NH3↑+HCl↑ B.Na2O+H2O=2NaOH
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2 =2Na2CO3+O2
难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol): P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2 mol白磷与氧气充分反应的能量变化为( )
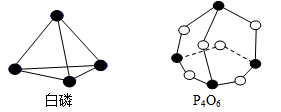
A.放热1638 kJ B.吸热1638 kJ C.吸热3276 kJ D.放热3276kJ
难度: 中等查看答案及解析
-
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,Y电极反应为Y-2e-=Y2+,可知X、Y、Z、W的还原性强弱顺序为( )
A.X>Z>Y>W B. Z>X>Y>W C.Z>Y>X>W D.Z>W>X>Y
难度: 中等查看答案及解析
-
下列事实与氢键有关的是( )
A.水结成冰体积膨胀
B.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高
C.水加热到很高的温度都难以分解
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
将0.2 mol MnO2和50 mL 12 mol·L-1盐酸混合后缓缓加热,反应完全后向余下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发) ( )
A.等于0.3 mol B.大于0.3 mol C.小于0.3 mol D.以上结论都不正确
难度: 中等查看答案及解析
-
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和
Cu(NO3)2。在所得溶液中加入1.0 mol/L 的NaOH溶液1.0 L,此时溶液呈中性,金属已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
A.Cu与Cu2O 的物质的量之比为2:1
B.产生的NO在标准状况下的体积为4.48 L
C.硝酸的物质的量浓度为2.6 mol/L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
难度: 简单查看答案及解析