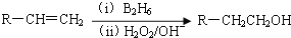-
(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
-
某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
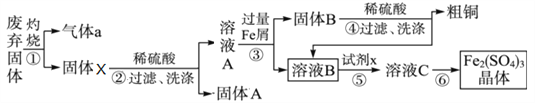
(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
-
乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为_____________;
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)

①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g) C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g) C2H2(g)+3H2(g) △H=______kJ·mol-1
C2H2(g)+3H2(g) △H=______kJ·mol-1
(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g) C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g) C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
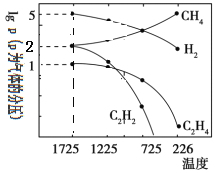
①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为_______;
②1725℃时,反应2CH4(g) C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
-
碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
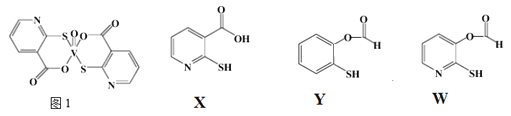
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用
 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示( 表示V,
表示V, 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
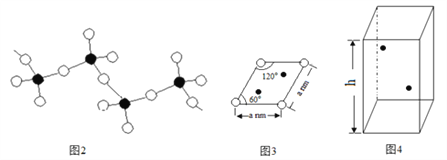
①请在图4中用 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
-
下图中I是一种高分子化合物,其合成路线如图:
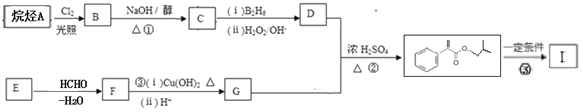

已知:①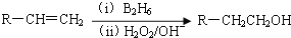
②回答下列问题:
(1)A的名称为_______(系统命名法),G含有的官能团_____(写名称)。
(2)反应①的反应类型是________.
(3)I的结构简式为_____________________________;
(4)反应②的化学方程式为__________________________________。
(5)符合下列条件的G的同分异构体共有___________种。
①与G具有相同官能团; ②属于芳香族化合物
(6)参照上述合成路线,设计一条由乙醛、甲醇和J(E的同系物且相对分子质量比E小14)为主要原料(无机试剂任选)制备 的合成路线______________。
的合成路线______________。

HCO3-+OH-的Kh=10-10mol·L-1