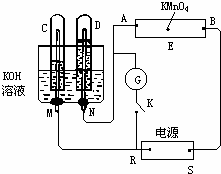
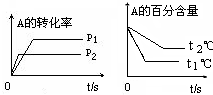
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
A.0.15mol•L-1
B.0.2mol•L-1
C.0.3mol•L-1
D.0.4mol•L-1难度: 中等查看答案及解析
-
下列各变化中,属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更容易氧化金属铜难度: 中等查看答案及解析
-
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol分析下列说法中正确的是( )
A.1mol S燃烧放出的热量为297.23kJ
B.S(g)+O2(g)=SO2(g) 放出的热量大于297.23kJ
C.S(s)+O2(g)=SO2(s) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的能量小于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的能量难度: 中等查看答案及解析
-
已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:
①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3.
下列关系式中正确的是( )
A.Q1<Q3<Q2
B.Ql<Q2<Q3
C.Q1<Q2=Q3
D.Q1=Q2=Q3难度: 中等查看答案及解析
-
在2A+B═3C+4D反应中,表示该反应速率最快的是( )
A.υ(B)=0.3 mol•-1
B.υ(A)=0.5 mol•-1
C.υ(C)=0.8 mol•-1
D.υ(D)=1 mol•-1难度: 中等查看答案及解析
-
把0.02mol/LCH3COOH和0.01mol/LNaOH以等体积混和,则混合液中微粒浓度关系正确的为( )
A.(CH3COO-)<C(Na+)
B.C(CH3COOH)+C(CH3COO-)=0.01mol/L
C.C(CH3COOH)>C(CH3COO-)
D.无法判断难度: 中等查看答案及解析
-
一定条件下反应A2(g)+B2(g)⇌2AB(g)达到平衡状态的标志是( )
A.υ(正、A2)=υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态难度: 中等查看答案及解析
-
已知25℃时,下列酸的电离常数:醋酸:1.75×10-5 氢氰酸:4.93×10-10 氢氟酸:7.2×10-4 甲酸:1.77×10-4 则物质的量浓度均为0.1mol•L-1的上述溶液酸性最强的是( )
A.醋酸
B.氢氰酸
C.氢氟酸
D.甲酸难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H++2e-═H2↑
B.Fe2++2e-═Fe
C.2H2O+O2+4e-═4OH-
D.Fe3++e-═Fe2+难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.它的充放电反应按式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O.由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2
B.Ni(OH)2
C.NiO(OH)
D.Cd难度: 中等查看答案及解析
-
水的电离过程为H2O⇌H++OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是( )
A.[H+]随温度的升高而降低
B.水的电离过程是吸热的
C.水的电离平衡常数与浓度、温度有关
D.在35℃时,[H+]>[OH─]难度: 中等查看答案及解析
-
1mL pH值相同的醋酸和盐酸,分别用蒸馏水稀释到100mL,稀释后两溶液的pH 分别为m和n( )
A.m>n
B.m=n
C.m<n
D.不能确定难度: 中等查看答案及解析
-
在水中加入下列物质,可以促进水电离的是( )
A.H2SO4
B.NaOH
C.Na2CO3
D.KNO3难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连可以组成多种原电池:若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由强到弱为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a难度: 中等查看答案及解析
-
摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY
B.HZ、HY、HX
C.HX、HY、HZ
D.HY、HZ、HX难度: 中等查看答案及解析
-
用石墨作电极电解CuCl2溶液,当通电一段时间后,收集到2.24L气体(标准状况).下列有关说法正确的是( )
A.阳极生成的铜
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液呈碱性难度: 中等查看答案及解析
-
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
B.pH为1的溶液:Cu2+、Na+、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合PH由小到大顺序排列的是( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.NaHCO3Na2CO3 NH4Cl NaCl
C.NH4Cl (NH4)2SO4 Na2S NaNO3
D.(NH4)2SO4 NH4Cl NaNO3 Na2S难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸的电离 H2CO3⇌H++HCO3-
B.将金属钠加入水中 Na+2H2O=Na++2OH-+H2↑
C.硫化钠水解 S2-+2H2O=H2S↑+2OH-
D.向氯化铝溶液中加入过量的烧碱溶液 Al3++3OH-=Al(OH )3↓难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析