-
当今国际能源研究的热点之一是寻找新能源,下列能源不属于新能源的是
A.太阳能 B.氢能
C.地热能 D.水能
难度: 简单查看答案及解析
-
2008年初,中国南方的大雪引发了巨大灾难。下列说法不正确的是
A.雪是由水蒸气凝华而成的,该过程有能量放出
B.雪融化为水后能量增加
C.雪融化为水时要吸收能量,导致环境温度升高
D.在雪上撒大量的以NaCl、MgCl2等为主要成分的融雪剂
难度: 简单查看答案及解析
-
有关糖类物质概念的叙述中,正确的是
A.糖类都是具有甜味的物质
B.糖类都是符合通式Cn(H2O)m的物质
C.葡萄糖具有还原性,它是一种多羟基醛
D.淀粉是一种白色粉末,本身有甜味
难度: 简单查看答案及解析
-
欲将蛋白质从水溶液中析出而又不改变蛋白质的性质,应加入的试剂是
A.
溶液 B.(NH4)2SO4溶液
C.CuSO4溶液 D.酒精溶液
难度: 简单查看答案及解析
-
苹果汁是人们喜爱的饮料,由于该饮料中含有Fe2+,苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入少量维生素C,则可防止这种现象发生。这说明维生素C具有
A.还原性 B.氧化性
C.碱性 D.酸性
难度: 简单查看答案及解析
-
下列二肽水解时化学键断裂位置正确的是
A.a B.b C.c D.d
难度: 简单查看答案及解析
-
某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是
A、Fe2+、Cu2+ B、 Cu2+ 、 H+
C、 Zn2+ 、Fe2+ D、 Zn2+ 、H+
难度: 简单查看答案及解析
-
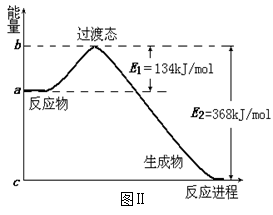
下列各组变化中,ΔH或Q前者小于后者的一组是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1; H2(g)+O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①②③ B.②④
C.②③④ D.③④
难度: 简单查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= ―2800 kJ/mol
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施能使制取氢气生成速率加大的是:
A.降温 B.不用稀硫酸,改用98%浓硫酸
C.不用稀硫酸,改用稀硝酸 D.滴加少量CuSO4溶液
难度: 简单查看答案及解析
-
2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为2221.5 kJ·mol-1;正丁烷的燃烧热为2878 kJ·mol-1;异丁烷的燃烧热为2869.6 kJ·mol-1;下列有关说法正确的是
A.丙烷燃烧的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)ΔH=-2221.5 kJ/mol-1
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.正丁烷比异丁烷稳定
D.奥运火炬燃烧时主要是将化学能转变为热能和光能
难度: 简单查看答案及解析
-
强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1) △H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H =- Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) △H =- Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =- Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
(A)Q1=Q2=Q3 (B)Q2>Q1>Q3 (C)Q2>Q3>Q1 (D)Q2=Q3>Q1
难度: 简单查看答案及解析
-
在2L的密闭容器里充入4molN2和6molH2,在一定条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用氮气表示反应速率为( )mol/Lmin
A 0.05 B 0.1 C 0.125 D 0.25
难度: 简单查看答案及解析
-
可以证明可逆反应N2+3H22NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体积压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速率v(NH3)=0.4mol/L·min
⑧υ正(N2)=υ逆(NH3)
⑨2υ正(H2)=3υ逆(NH3)
A. 全部 B. 只有①③④⑤⑨
C. ②③④⑤⑦⑨ D. 只有①③⑤⑥⑦
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡:Cl2+H2O
HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2
2NH3;DH<0)
难度: 简单查看答案及解析
-
下图中a曲线表示一定条件下可逆反应X(g)+2Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
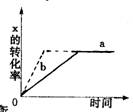
A 加入催化剂 B 增大Y的浓度
C 降低温度 D 增大体系压强
难度: 简单查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是

A正反应为吸热反应 L是气体
B正反应为放热反应 L是固体或液体
C正反应为吸热反应 L是固体
D正反应为放热反应 L是气体
难度: 简单查看答案及解析
-
在密闭容器中有可逆反应:
处于平衡状态(已知n+m>p),则下列说法正确的是
①升温,c(B)/c(c)的比值变小
②降温时体系内混合气体的平均相对分子质量变小
③加入B,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为υA,则B的反应速率为υAn/m
A.①②③⑤ B.①②③④
C.①②⑤⑥ D.③④⑤⑥
难度: 简单查看答案及解析
-
在一密闭容器中,反应mA(g )
nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
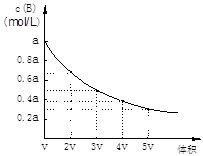
A.物质B的质量分数增加
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
难度: 简单查看答案及解析
-
一定温度和压强下,下列各可逆反应达到化学平衡状态,各反应有如图所示的对应关系:
(1)N2(g)+3H2(g) 2NH3(g);ΔH<0(曲线Ⅰ)
(2)H2(g)+I2(g) 2HI(g);ΔH>0(曲线Ⅱ)
(3)2SO3(g) 2SO2(g) +O2(g);ΔH>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是
A.平衡混合气中一种生成物的物质的量浓度
B.平衡混合气中一种反应物的体积分数
C.平衡混合气的平均相对分子质量
D.平衡混合气中一种反应物的转化率
难度: 简单查看答案及解析