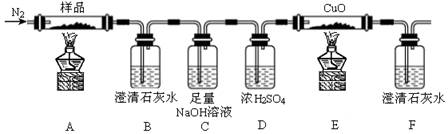
-
某芳香烃分子式为C9H12 ,其苯环上的一氯代物有两种的同分异构体有()
A.1种 B. 2种 C. 3种 D.4种
难度: 简单查看答案及解析
-
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的卤代烃的种类共有()
A.2 B.4 C.5 D.6
难度: 简单查看答案及解析
-
下列反应中,反应物和产物的空间构型不会发生本质变化的是()
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列各组中的反应,属于同一反应类型的是()
A.苯的硝化反应;乙烯使溴水褪色
B.葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯
C.乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷
D.乙醇和氧气制乙醛;苯和氢气制环己烷
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的数值,下列说法正确的是()
A.1L 1mol·L-1的NH4NO3溶液中氮原子数小于2 NA
B.常温常压下,11.2 g乙烯中含有共用电子对数目为2.4 NA
C.在O2参加的反应中,1molO2作氧化剂时得到的电子数一定是4 NA
D.标准状况下,22.4 L CCl4中所含有的分子数为NA
难度: 简单查看答案及解析
-
下列实验操作不能达到其对应目的是()
编号
实验操作
目 的
A
取4gNaOH加入96mL水中(水的密度近似看作1g/cm3)
配制4%的NaOH溶液
B
配制一定物质的量浓度的溶液实验中,用蒸馏水润洗容量瓶
避免造成误差,且不会使所配制溶液浓度偏低
C
向CH3COONa溶液中滴入酚酞溶液,加热
证明升高温度能促进CH3COONa水解
D
向盛有铜片的试管中加入浓硫酸,加热
证明浓硫酸具有强氧化性
难度: 简单查看答案及解析
-
下列离子方程式中表达正确的是()
A.等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合时发生反应:
HCO3- + Ba2+ + OH- = BaCO3↓+ H2O
B.向AlCl3溶液中加入过量氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C.用铜作电极电解硫酸溶液:2H2O
2H2↑+O2↑
D.硫酸亚铁溶液和稀硫酸、过氧化氢混合:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O
难度: 简单查看答案及解析
-
下列各选项中所述的两个量,前者一定大于后者的是()
A.pH=10的NaOH和Na2CO3溶液中,水的电离程度
B.物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度
C.将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量
D.相同温度下,10mL 0.1mol·L-1的醋酸和100mL 0.01mol·L-1的醋酸中H+物质的量
难度: 简单查看答案及解析
-
由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是()
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲含有相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价的元素
难度: 简单查看答案及解析
-
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是()
A.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素
B.X、M两元素氢化物的稳定性:X<M
C.Z和W的氧化物均可做耐高温材料,M的氧化物可做太阳能电池
D.X、W的最高价氧化物的水化物间反应生成一种可净水的化合物
难度: 简单查看答案及解析
-
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用下图装置进行实验探究,下列说法正确的是()
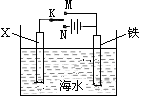
A.X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑
B.X为锌棒,K置于M,外电路电流方向是从X到铁
C.X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法
D.X为碳棒,K置于N,在X电极周围首先失电子的是Cl-
难度: 简单查看答案及解析
-
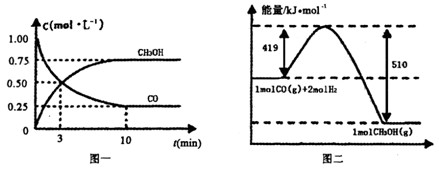
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应
3M (g) + N (g)
xP (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol·L-1·min-1,则下列说法正确的是()
A.方程式中x=2
B.达平衡后,容器内压强是反应起始时的2倍
C.向容器中再充入3.0molM和2.5molN,达新平衡时Q 的体积分数减小
D.容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志
难度: 简单查看答案及解析
-
加热N2O5,依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g), ②N2O3(g)
N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为()
A.10.7 B.8.5 C.9.6 D.10.2
难度: 简单查看答案及解析
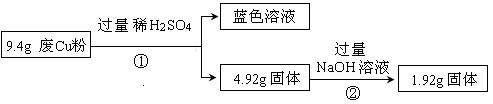

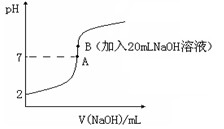
 。
。