-
在全球气候变暖的背景下,以低能耗、低污染为基础的“低碳经济”成为发展趋向。下列不属于“促进低碳经济”宗旨的是
A.提高能源效率、寻找替代能源、保护森林以及生态友好型消费
B.推广以液化石油气代替天然气作民用燃料
C.推广利用二氧化碳与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料
D.推广“绿色自由”计划,吸收空气中CO2并利用廉价能源合成汽油
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.乙醛的结构简式: C2H4O B.F原子的结构示意图:
C.中子数为20的氯原子:
Cl D.NH3的电子式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红的溶液中:Cr2O72- 、Fe2+、SO42-、K+
B.0. 1mol·L-1NaHCO3溶液: Na+、Ba2+、NO3- 、Cl-
C.0. 1mol·L-1FeCl3溶液: K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3-
难度: 困难查看答案及解析
-
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解精炼铜时,阳极溶解铜的质量比阴极析出铜的质量小
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
难度: 中等查看答案及解析
-
下列有关物质的性质或应用不正确的是
A.一定条件下,镁和铁的单质与水反应都有氢气生成
B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹
难度: 简单查看答案及解析
-
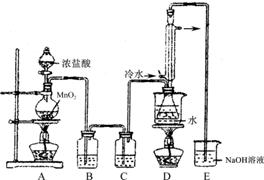
用下列实验装置进行相应实验,能达到实验目的的是
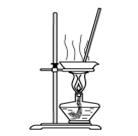

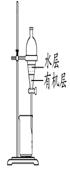

图1 图2 图3 图4
A.用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.用图2所示装置制取少量乙烯气体
C.用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层
D.用图4所示装置制取少量Cl2气体
难度: 中等查看答案及解析
-
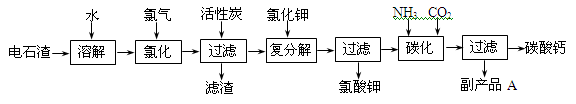
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.除去与水反应,图5所示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.1molCl2参加的任何反应,反应过程中转移电子数都是2NA
B.常温下,98g H2SO4和H3PO4的混酸中所含的分子数为NA
C.标准状况下,11. 2 LCCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24 L NO2和CO2混合气体中含有的氧原子数目为0. 2NA
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向NaAlO2溶液中通入过量CO2:2AlO2- + CO2 + 3H2O=2Al(OH)3↓ + CO32-
B.小苏打与氢氧化钠溶液混合:HCO3- + OH-=CO2↑+H2O
C.在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-= BaCO3↓+H2O
D.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)=Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是

图6 图7 图8 图9
A.图6表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂,也可能是改变压强
B.图7表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图8表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图9表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
难度: 简单查看答案及解析
-
火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2 + O2 = Cu2S + 2FeS + SO2。下列说法不正确的是
A.SO2既是氧化产物又是还原产物 B.CuFeS2仅作还原剂,硫元素被氧化
C.每转移0.8mol电子,有0.2mol硫被氧化 D.每生成1molCu2S,有1mol硫被氧化
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.元素X 的简单氢化物的沸点比W 的氢化物的沸点高
B.元素Y 的最高价氧化物对应水化物的为强碱
C.化合物YX、ZX2、WX2中化学键的类型相同
D.原子半径的大小顺序: rY >rZ >rW >rX
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀说明溶液X 中一定含有SO42-
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.粗略配制浓度为2 mol·L—1的NaCl溶液,可将58.5gNaCl加入到盛有500mL水的烧杯中,搅拌、溶解
D.对某固体进行焰色反应实验,火焰呈黄色,说明该物质为一定钠盐
难度: 简单查看答案及解析
-
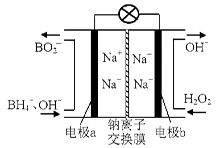
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是
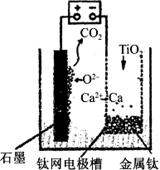
A.该电池工作过程中O2-向阴极移动
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.若用铅蓄电池作该装置的供电电源,“-”接线柱应连接PbO2电极
D.在制备金属钛前后,整套装置中CaO的总量减少
难度: 简单查看答案及解析
-
工业上用CO生产甲醇的反应为CO(g)+2H2(g)
CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是

图10 图11 图12
A.CO和H2合成CH3OH的反应:△H<0,△S>0
B.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C.图10中曲线b可表示使用了催化剂的能量变化情况
D.图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况
难度: 中等查看答案及解析