-
下列与化学反应能量变化相关的叙述中正确的是
A. 已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol
B. 等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多
C. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH<0
难度: 中等查看答案及解析
-
下列判断错误的是 ( )
①反应2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
②反应NH3(g)+HCl(g)=NH4Cl(s)在常温下能自发进行,则该反应的△H<0
③反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能自发进行,说明该反应的△H<0
④一定温度下,反应2MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0
A. ①②③ B. ②③ C. ②④ D. ①③
难度: 简单查看答案及解析
-
下列条件的改变,一定会同时影响化学反应速率和化学平衡的是
A. 浓度 B. 压强 C. 温度 D. 催化剂
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
难度: 简单查看答案及解析
-
在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g)
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
难度: 中等查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
难度: 中等查看答案及解析
-
在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A. pH=3的HNO3跟pH=11的KOH
B. pH=3的盐酸跟pH=11的氨水
C. pH=3的醋酸跟pH=11的Ba(OH)2
D. pH=3硫酸跟pH=11的NaOH
难度: 中等查看答案及解析
-
常温下,下列四种溶液中,由水电离出的氢离子浓度之比为( )
①pH=0的盐酸 ②0.1 mol/L的盐酸 ③0.01 mol/L的NaOH溶液 ④pH=11的NaOH溶液
A. 1:10:100:1000 B. 0:1:12:11 C. 14:13:12:11 D. 14:13:2:3
难度: 中等查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
A. 用蒸馏水冼净滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液
C. 用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积
D. 用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
难度: 中等查看答案及解析
-
将pH=5的H2SO4溶液稀释500倍,稀释溶液后,c(H+)与c(SO42-)的比值近似为
A. 1:1 B. 1:2 C. 10:1 D. 2:1
难度: 中等查看答案及解析
-
有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与NaCl②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)从大到小排序正确的是( )
A. ②>④>③>① B. ②>④>①>③ C. ③>①>②>④ D. ①>④>③>②
难度: 中等查看答案及解析
-
有四种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH<7,BX的溶液的pH>7。则可能不水解的盐是
A. AX B. BX C. AY D. BY
难度: 中等查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
难度: 困难查看答案及解析
-
某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。据图判断正确的是

A. II 为盐酸稀释时pH 值变化曲线 B. b 点溶液的导电性比c 点溶液的导电性强
C. a 点Kw的数值比c点Kw的数值大 D. b点酸的总浓度大于a 点酸的总浓度
难度: 困难查看答案及解析
-
对于0.1mol•L-1 Na2CO3溶液,正确的是
A. 升高温度,溶液的pH降低
B. c(Na+)=2c(CO32―)+c(HCO3―)+ c(H2CO3)
C. c(Na+)+c(H+)=2c(CO32―)+ 2c(HCO3―)+ c(OH―)
D. 加入少量NaOH固体,c(CO32―)与c(Na+)均增大
难度: 中等查看答案及解析
-
常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
A. V一定等于0.2
B. V大于或等于0.2
C. 混合溶液中离子浓度一定满足:c(Cl-)>c(NH
)> c(H+)>c(OH-)
D. 混合溶液中离子浓度一定满足:c(NH
)+c(H+)= c(Cl-)+c(OH-)
难度: 困难查看答案及解析
-
常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液。下列判断不正确的是
A. ①与②比较:c(Na+)>c(NH4+)
B. ①中的离子浓度的大小关系是:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
C. 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO﹣)>c(Na+)
D. ①与②等体积混合的溶液中:c(Cl﹣)=c(NH4+)+c(Na+)+c(NH3•H2O)
难度: 困难查看答案及解析
-
往水中加入下列物质,对水的电离平衡不产生影响的是
A. NaHSO4 B. CH3COOK C. KAl(SO4)2 D. NaI
难度: 简单查看答案及解析
-
由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是
酸
电离常数
碳酸
K1=4×10-7 K2=5.6×10-11
亚硫酸
K1=1.54×10-2 K2=1.02×10-7
A.SO2+H2O+2CO32-="2" HCO3-+SO32-
B.SO2+H2O+CO32-=H2CO3+SO32-
C.2SO2+2H2O+CO32-=H2CO3+2 HSO3-
D.SO2+H2O+CO32-= HCO3-+HSO3-难度: 中等查看答案及解析
-
下列根据反应原理设计的应用,不正确的是( )
A. CO32-+H2O
HCO3-+OH- 与Al2(SO4)3溶液混合作灭火剂
B. Al3++3H2O
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D. SnCl2+H2O
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
难度: 中等查看答案及解析
-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K/(mol·L-1)
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX溶液的电离常数
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A. Ba(OH)2、Na2SO3、FeCl3、KCl
B. Na2SiO3、Na2SO3、KNO3、NH4Cl
C. NH3·H2O、H3PO4、Na2SO4、H2SO4
D. NaHCO3、CH3COOH、C2H5OH、HCl
难度: 中等查看答案及解析
-
已知25℃时,Ksp(BaSO4)=1.1×10-10。则在5.0%的Na2SO4溶液中(假设溶液的密度为1 g·cm-3),Ba2+的最大浓度是( )
A. 4.2×10-10 mol·L-1 B. 8.4×10-10 mol·L-1
C. 3.1×10-10 mol·L-1 D. 5.8×10-10 mol·L-1
难度: 中等查看答案及解析
-
向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
难度: 中等查看答案及解析
-
分析下图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
难度: 中等查看答案及解析
-
有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,外电路电流从b流向a;将a、d分别投入等浓度盐酸中,d比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;将铜浸入c的盐溶液中,有金属c析出。据此判断它们金属活动性顺序是
A. d>c>a>b B. d>a>b>c C. d>b>a>c D. b>a>d>c
难度: 中等查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
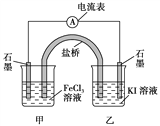
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流表读数为零时,反应达到化学平衡状态
D. 电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
难度: 困难查看答案及解析