-
已知25°C时:
电解质
Mg(OH)2
Cu(OH)2
Fe(OH)2
Fe(OH)3
溶度积
1.8×10-11
2.2×10-20
8.0×10-16
4.0×10-38
完全沉淀时的pH
9.7
5.0
5.5
4.0
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为____________(填化学式)而除去。
(2)试剂a为__________。
(3)写出②中除杂所发生的总反应的离子方程式:________________________________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在
高二化学填空题中等难度题查看答案及解析
-
以下是25 ℃时几种难溶电解质的溶度积:
难溶电解质
Mg(OH)2
Cu(OH)2
Fe(OH)2
Fe(OH)3
溶度积
1.8×10-11
2.2×10-20
8.0×10-16
4.0×10-38
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为_____________(填化学式)而除去。
(2)①中加入的试剂应该选择___________为宜,其原因是_____________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为________。
(4)下列与③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.在pH>4的溶液中Fe3+一定不能大量存在
高二化学实验题中等难度题查看答案及解析
-
已知常温下,几种难溶电解质的溶度积(Ksp):
化学式
Mg(OH)2
MgF2
Fe(OH)3
AgCl
Cu(OH)2
Ag2CrO4
溶度积
5.6×10-12
7.4×10-11
4 .0×10-38
1.8×10-10
2.2×10-20
2.0×10-12
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
高二化学单选题困难题查看答案及解析
-
已知常温下,几种难溶电解质的溶度积(Ksp):
化学式
Mg(OH)2
MgF2
Fe(OH)3
AgCl
Cu(OH)2
Ag2CrO4
溶度积
5.6×10-12
7.4×10-11
4 .0×10-38
1.8×10-10
2.2×10-20
2.0×10-12
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
高二化学单选题困难题查看答案及解析
-
已知常温下,几种难溶电解质的溶度积(Ksp):
化学式
Mg(OH)2
MgF2
Fe(OH)3
AgCl
Cu(OH)2
Ag2CrO4
溶度积
5.6×10-12
7.4×10-11
4 .0×10-38
1.8×10-10
2.2×10-20
2.0×10-12
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
高二化学单选题困难题查看答案及解析
-
以下是25℃时几种难溶电解质的溶度极数值:
难溶电解质
Mg(OH)2
Cu(OH)2
Fe(OH)2
Fe(OH)3
Ksp
1.0×10-12
1.0×10-20
1.0×10-16
1.0×10-38
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为___________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。
(4) 向浓度均为0.1mol/L-1的Fe(NO3)3和Cu(NO3)2混合溶液中,逐滴加入NaOH.下列示意图表示生成沉淀的总物质的量与加入NaOH的体积的关系,合理的是(____)

(5)若将某MgCl2、FeCl3均为0.1 mol·L-1混合溶液中的pH用MgO调整至pH=4,则溶液中
比值约为______________________。
高二化学综合题中等难度题查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25°C)
8.0×10−16
2.2×10−20
4.0×10−38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4
C.向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
高二化学单选题困难题查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25°C)
8.0×10−16
2.2×10−20
4.0×10−38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A. 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B. 该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4
C. 向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液
D. 在pH=5的溶液中Fe3+不能大量存在
高二化学单选题困难题查看答案及解析
-
某学生欲用电解纯净CuSO4 溶液的方法来测定铜的相对原子质量。其实验过程如图所示:
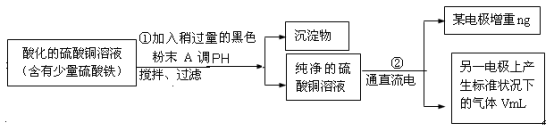
(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。
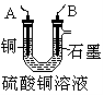
(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
高二化学填空题困难题查看答案及解析
-
常温下,已知Mg(OH)2溶度积常数Ksp=1.8×10-11,则足量Mg(OH)2固体溶解在pH=12的NaOH溶液中Mg2+浓度为( )
A.1.8×10-7mol/L B.1.0×10-5mol/L
C.1.0×10-7mol/L D.1.8×10-9mol/L
高二化学单选题中等难度题查看答案及解析