-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则表示甲烷燃烧热的热化学方程式为( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H═+890kJ•mol-1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H═+890kJ•mol-1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H═-890kJ•mol-11
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H═-890kJ•mol-1-1难度: 中等查看答案及解析
-
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
A.C+H2O═CO+H2△H=+131.28kJ•mol-1
B.C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94 kJ•mol-1
C.C(s)+H2O(l)═CO(g)+H2(g)△H=+131.28kJ•mol-1
D.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1难度: 中等查看答案及解析
-
已知反应A+3B⇌2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol•L-1•min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5mol•L-1•min-1
B.1mol•L-1•min-1
C.2mol•L-1•min-1
D.3mol•L-1•min-1难度: 中等查看答案及解析
-
把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度②镁带的表面积 ③溶液的温度 ④氯离子的浓度.对反应速率有影响的是( )
A.①②
B.③④
C.①②③④
D.①②③难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol.分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系表示正确的是( )
A.△H2<△H3<△H1
B.△H1>△H2>△H3
C.△H1=△H2=△H3
D.△H2>△H3>△H1难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列能源符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
A.①②③④
B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧难度: 中等查看答案及解析
-
反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.υ(D)=0.4 mol/
B.υ(C)=0.5 mol/
C.υ(B)=0.6 mol/
D.υ(A)=0.15 mol/难度: 中等查看答案及解析
-
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小的顺序排列,正确的是( )
①500℃,10mol SO2和5mol O2反应
②500℃,用V2O5作催化剂,10mol SO2和5mol O2反应
③450℃,8mol SO2和5mol O2反应
④500℃,8mol SO2和5mol O2反应.
A.①②③④
B.②①③④
C.②①④③
D.④③②①难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.据能量守恒定律,反应物的总能量一定等于生成物的总能量
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生难度: 中等查看答案及解析
-
下列过程中△H小于零的是( )
A.氯酸钾分解制氧气
B.氯化铵分解得氨气
C.碳酸钙分解得二氧化碳
D.酸碱中和难度: 中等查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)Sn(s,白)△H3=+2.1kJ•mol-1,下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏难度: 中等查看答案及解析
-
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
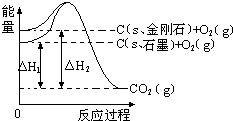
A.C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石比石墨稳定
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)=H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )kJ•mol-1.
A.+488.3
B.-244.15
C.-488.3
D.+244.15难度: 中等查看答案及解析
-
在一个容积为2L的密闭容器中,发生如下反应:3A+B⇌2C (A、B、C均为气体),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/,则10s后容器中的B是( )
A.2.8mol
B.1.6mol
C.3.2mol
D.3.6mol难度: 中等查看答案及解析
-
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol•L-1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)⇔2SO3(g),能增大正反应速率的措施是( )
A.增大容器容积
B.移去部分SO3
C.通入大量O2
D.降低体系温度难度: 中等查看答案及解析
-
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率减小的是( )
A.增加C的量
B.将容器体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大难度: 中等查看答案及解析