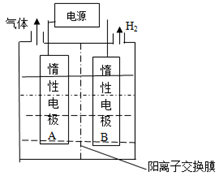
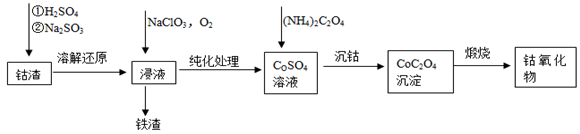
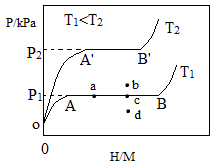
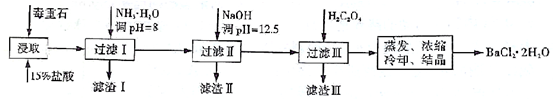
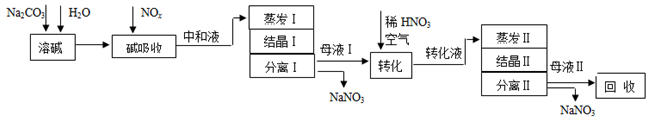
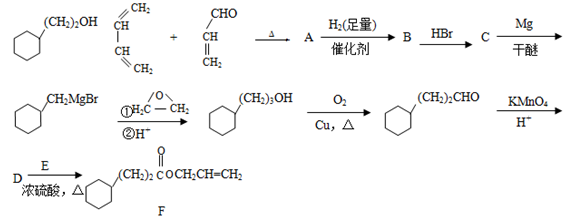
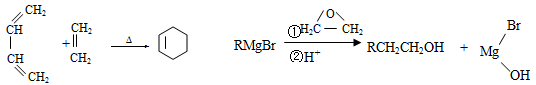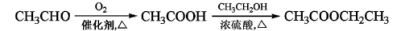-
进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是
Y
Z
X
W
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
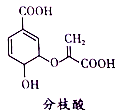
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入BaHCO3溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
难度: 中等查看答案及解析
-
下列由实验现象得出的结论正确的是
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)< Ksp(AgI)
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br—还原性强于Cl—
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4+
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
难度: 困难查看答案及解析
-
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
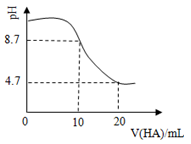
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
难度: 中等查看答案及解析