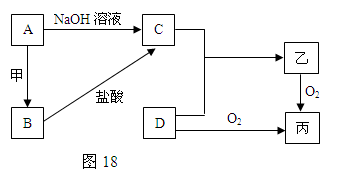
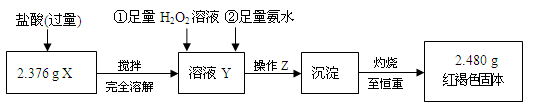
-
对于工农业生产和日常生活中与化学相关的问题,下列认识正确的是( )
A.明矾净水与液氯净水的原理相同
B.镀层破损后,镀铜铁板比镀锌铁板更耐腐蚀
C.从海带中提取碘单质的过程涉及氧化还原反应
D.“钡餐”中使用的硫酸钡是弱电解质,碳酸钠可用于治疗胃酸过多症
难度: 中等查看答案及解析
-
常温下,下列各溶液中能大量共存的离子组是( )
A.由水电离出的c(H+) = 10-12 mol·L-1 的溶液中:Na+、Ca2+、K+、HSO3-
B.在pH = 2的的溶液中:Fe2+、I-、NO3-、Cl-
C.c(OH-) = 10-12 mol·L-1 的溶液中: K+、SO42-、Cl-、HCO3-
D.使酚酞试液呈红色的溶液中:Na+、AlO2-、NO3-、SO42-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的组合是( )
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1 NA
② 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③ 标准状况下,2.24 L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA。
④ 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH- 数目为0.2 NA
⑤ 100 mL 1 mol·L-1 AlCl3溶液中含阳离子数大于0.1 NA
⑥ 7.8 g Na2O2与足量CO2反应,转移电子数为0.1 NA
⑦ 13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2 NA
⑧ 标准状况下,2.24 L H2O含有的电子数为NA
A.①②⑥⑧ B.①⑤⑥⑦
C.②④⑥⑦ D.③⑤⑥⑧
难度: 中等查看答案及解析
-
下列离子检验的结论可靠的是( )
A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰呈黄色,证明不含K+
B.向溶液中加入新制氯水和CCl4,振荡、静置,若下层溶液呈紫红色,证明含有I-
C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+
D.向溶液中滴加BaCl2溶液后再加入稀盐酸,若产生白色沉淀,证明含有SO42-
难度: 中等查看答案及解析
-
如图3,装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电时的化学方程式为:
装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
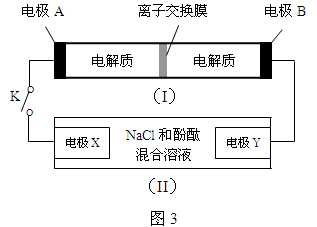
A.电极A上发生的反应为:2S22- - 2e- === S42-
B.K+从右到左通过离子交换膜
C.电极X上发生的反应为:2Cl-- 2e- === Cl2↑
D.当有0.1 mol K+通过离子交换膜,Y电极上产生2.24 L气体(标准状况)
难度: 中等查看答案及解析
-
将一定量的镁铝合金样品分成丽等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L。则原合金样品中镁的质量为( )
A.4.8 g B.6g C.9.6g D.12g
难度: 中等查看答案及解析
-
在密闭容器中进行反应2SO2 (g) + O2 (g)
2SO3 (g) ,△H < 0 。如图4是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的原因可能是( )
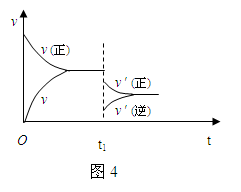
A.催化剂失效
B.减小了生成物的浓度
C.降低了体系的温度
D.增大了容器的体积
难度: 中等查看答案及解析
-
下面的图5中右图的分子酷似左图的企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone。下列有关Penguinone的说法不正确的是( )

A.属于一取代的酚类且与Penguinone互为同分异构体的化合物有9种
B.Penguinone的分子式为C10H14O
C.Penguinone能使酸性高锰酸钾溶液褪色
D.1 mol Penguinone能与3 mol氢气反应
难度: 中等查看答案及解析