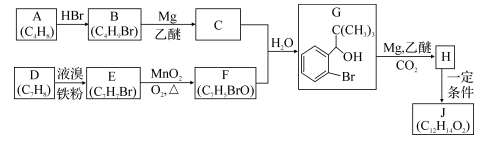
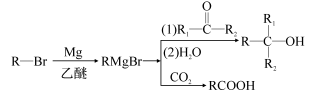
-
只选用下列试剂中的一种就可以鉴别氯化铁、硝酸钠、氯化铝和硫酸镁四种溶液。这种试剂是
A. BaCl2 B. KSCN
C. NaOH D. AgNO3
难度: 简单查看答案及解析
-
化学与人类社会的生活、生产密切相关。 以下说法不正确的是
A. 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料
B. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
C. 8 4消毒液的有效成分NaClO具有强氧化性,能用来杀菌消毒
D. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
难度: 简单查看答案及解析
-
《神农本草经》说:“水银……镕化(加热)还复为丹”。 《黄帝九鼎神丹经》中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。 这里的“丹”是指
A. 合金 B. 氧化物 C. 氯化物 D. 硫化物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 18gD2O(重水)中含有1 0NA个质子
B. 7 8g苯中含有3NA个 C=C双键
C. 1L0.1mo l / LNaHCO3溶液中含有0.1NA个 HCO3 -
D. ag某气体中含分子数为b,cg该气体在标况下的体积为
难度: 简单查看答案及解析
-
下列实验操作中错误的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出
D.萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶
难度: 简单查看答案及解析
-
含下列离子组的溶液中加入相应试剂后,发生反应的离子方程式正确的是
离子组
加入试剂
离子方程式
A
Cu2+、SO4 2 -
Ba(OH)2 溶液
Ba 2+ +SO4 2 - =BaSO4↓
B
Al3+、NO3 -
过量氨水
Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
C
Fe3+ 、Cl -
铁粉
Fe3+ +Fe=2Fe2+
D
Fe2+、I-
足量新制氯水
Cl 2+2I -=2Cl- +I2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关说法错误的是
A. 金属 Mg与稀硫酸、CO2 均能反应,但其反应类型不同
B. 浓硫酸与铜反应既体现了其强氧化性又体现了其酸性
C. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到 Fe3O4
D. SO2气体通入Ba(NO3)2溶液中,有白色沉淀生成
难度: 简单查看答案及解析
-
向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、NO3-、SO42-
B. N点对应的溶液中:K+、NH4+、CO32-、Cl﹣
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、NO3-、SO42-、Cl﹣
难度: 困难查看答案及解析
-
已知 NH4CuSO 3 与足量的2mo l / L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。 据此判断下列说法不正确的是
A. NH4CuSO 3 中铜元素既被氧化又被还原
B. 刺激性气味的气体是二氧化硫
C. 反应中硫酸作氧化剂
D. 2mo lNH4CuSO 3 完全反应转移1mo l电子
难度: 中等查看答案及解析
-
足量的NaHSO3溶液和Na2CO3溶液混合后能产生CO2气体。下列说法正确的是
A. HSO3-的水解程度大于其电离程度
B. 上述反应的离子方程式为2H++CO32- = H2O+CO2↑
C. 向Na2CO3溶液中通入足量SO2,也可得到CO2
D. NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-)>c(H+)
难度: 中等查看答案及解析
-
玉米芯与稀硫酸在加热加压下反应,可以制得糠醛(结构简式如图)。 糠醛是重要的化工原料,用途广泛。 关于糠醛的说法,不正确的是

A. 糠醛能使酸性高锰酸钾溶液褪色
B. 1mol糠醛可与2mo lH2 发生加成反应
C. 其核磁共振氢谱有4种不同类型的吸收峰
D. 加热时糠醛与新制的 Cu(OH)2 悬浊液反应生成红色沉淀
难度: 简单查看答案及解析
-
处理含 CO、SO2 烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。已知:
2CO(g)+O2(g)=2 CO2(g) △H1=-566.0kJ/mol
S(g)+O2(g)=SO2(g) △H2=-296.0kJ/mol
S(s)+O2(g)=SO2(g) △H3=?
下列说法不正确的是
A. △H3<△H2
B. 将少量 CO 2、SO2分别通入澄清石灰水,都能产生浑浊现象
C. CO2分子中各原子最外层均为8电子稳定结构
D. 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g) △H=-270kJ/mol
难度: 中等查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。 其中只有Z是金属,W的单质是黄色晶体,X、Y、W 在周期表中的相对位置关系如图所示。 下列说法不正确的是
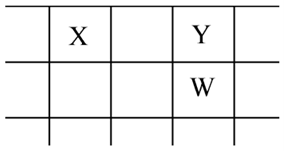
A. 5种元素中,原子半径最大的是Z
B. Y与Z形成的化合物都可以和盐酸反应
C. Z与Q形成的化合物水溶液一定显酸性
D. W的简单阴离子比Q的简单阴离子还原性强
难度: 简单查看答案及解析
-
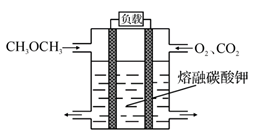
据报道,以硼氢化合物 NaBH4(B元素的化合价为+3价)和 H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用 MnO 2,可用作空军通信卫星电源,其工作原理如图所示。 下列说法不正确的是
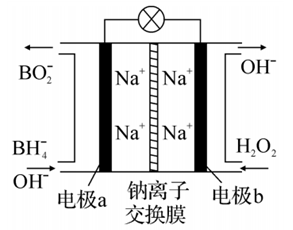
A. 电极a采用Pt/C,电极b采用 MnO2
B. 电池放电时 Na +从b极区移向a极区
C. 负极电极反应式为:BH4- +8OH- -8e-=BO2-+6H2O
D. 反应中每消耗3mo lH2O2,转移6mol电子
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。 下列说法正确的是
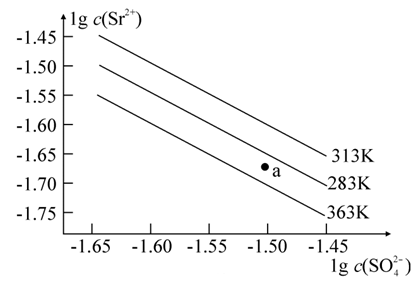
A. 283K时,图中a点对应的溶液是不饱和溶液
B. 温度一定时,Ksp(SrSO4) 随c(SO42-) 的增大而减小
C. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D. 三个不同温度中,363K时Ksp(SrSO4)最大
难度: 中等查看答案及解析