-
化学与生产、生活、社会发展等息息相关,下列说法正确的是
A. 煤经过气化、液化等物理变化可转变为清洁燃料
B. 为补充土壤中的钾元素,可在田间焚烧秸秆
C. 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质
D. 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染
难度: 简单查看答案及解析
-
X、Y、Z、W、M均为短周期元素。其中,X、Y同主族,Y元素形成的一种单质可保存在冷水中;Z、W、Y、M是第三周期连续的四种元素,原子半径依次减小。下列叙述不正确的是
A. X的液态单质可在医疗上用于冷冻麻醉
B. Y、M两元素气态氢化物的稳定性:Y<M
C. 工业上制备Z的单质可电解其熔融态的氧化物
D. 氧化物XO2与MO2均具有漂白性,且漂白原理相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g 铁与足量氯气反应,氯气共得到3NA个电子
难度: 中等查看答案及解析
-
下列实验装置或操作设计正确、且能达到目的的是( )
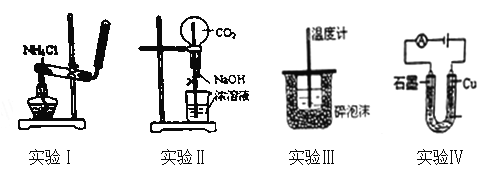
A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
难度: 简单查看答案及解析
-
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
难度: 简单查看答案及解析
-
在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
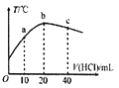
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3•H2O)+c(H+)
难度: 困难查看答案及解析



 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:  。___________________。
。___________________。