-
[化学一选修3:物质结构与性质](15分)第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO) ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO) 的晶体类型为________,Ni(CO)
的晶体类型为________,Ni(CO) 易溶于下列_______(填选项字母)中。
易溶于下列_______(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________FeO(填“>”或“<”),原因为_____________;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20 水中的溶解度之比为0.39,其原因为_________。
水中的溶解度之比为0.39,其原因为_________。
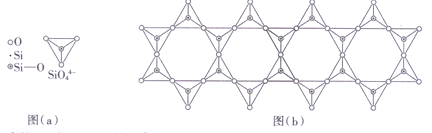
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________,其化学式为_________。
-
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
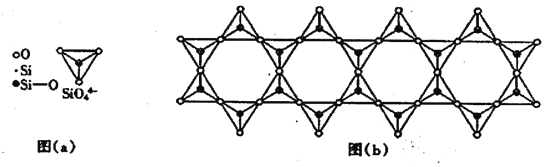
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
-
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
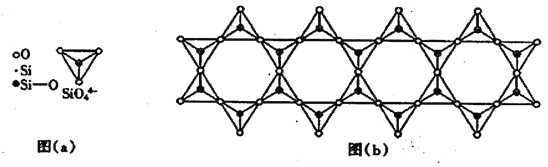
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
-
元素C与过渡元素Co、Fe等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布式为_______,第四电离能I4(Co)<I4(Fe),其原因是_________。
(2) (CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______。
(3)治疔铅中毒可滴注依地酸,使Pb2+转化为依地酸铅盐。如图,下列说法正确的是____(填序号)。
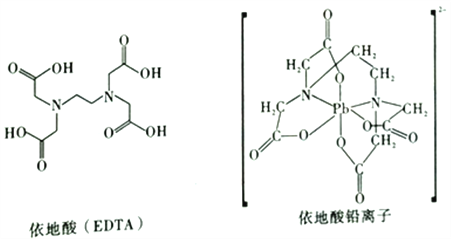
A.形成依地酸铅离子所需n(Pb2+) :n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)Fe(CO)x常温下是液态,熔点为-20.5℃,沸点为103℃,易容于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=______。
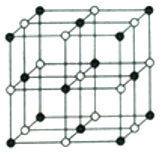
(5) Co的一种氧化物的晶胞如图.己知钴原于的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的_____(填“正八面体”“正四面体”或“立方体” )空隙中,在该钴的氧化物晶胞中原子的空间利用率为______(均用含a、b的计算表达式表示)。
-
过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为 __________;基态 Mn原子核外有____种运动状态不同的电子,M层的电子云有_______种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是 ____________________________________
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验 K+的存在。与NO2-互为等电子体的微粒__________(写出一种),K3[Co(NO2)6]中存在的作用力有___________a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH4-的空间构型为____________
(5)FeO 是离子晶体,其晶格能可通过下图中的 Born—Haber 循环计算得到。

可知,O原子的第一电子亲和能为 ________kJ•mol-1,FeO晶格能为________kJ•mol-1。
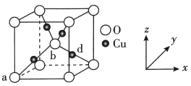
(6)铜与氧可形成如图所示的晶胞结构,其中 Cu 均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为_______________,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为_________pm
(列出计算式即可)
-
过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Mn原子核外有__个未成对电子,M层的电子云有__种不同的伸展方向。金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“__理论”解释。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是__。
(3)NO 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO 的中心原子的杂化形式为__,空间构型为__。大π键可用符号
的中心原子的杂化形式为__,空间构型为__。大π键可用符号 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为 ,则NO
,则NO 中大π键应表示为__。
中大π键应表示为__。
(4)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d点的坐标参数为__,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
),则d点的坐标参数为__,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。

-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
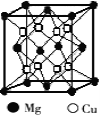
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。
(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH。
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
-
(14分)高纯硅晶体是信息技术的重要材料。
(1)在周期表的以下区域中可以找到类似硅的半导体材料的是______(填字母)。
A.过渡元素区域 B.金属和非金属元素的分界线附近
(2)工业上用石英和焦炭可以制得粗硅。已知:
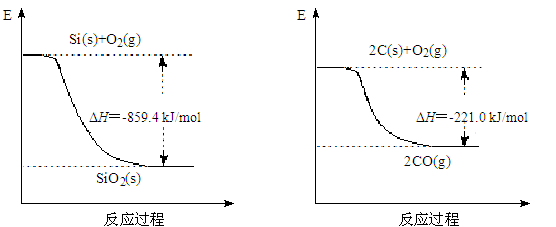
写出用石英和焦炭制取粗硅的热化学方程式 ______。
(3)某同学设计下列流程制备高纯硅:
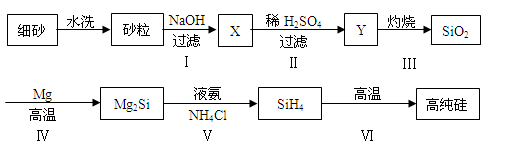
①Y的化学式为______。
②写出反应Ⅰ的离子方程式 。
③写出反应Ⅳ的化学方程式 。
④步骤Ⅵ中硅烷(SiH4)分解生成高纯硅,已知甲烷分解的温度远远高于硅烷,用原子结构解释其原因是 。
(4)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:
SiHCl3 (g) + H2(g)  Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
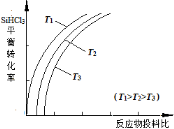
A.该反应是放热反应
B.横坐标表示的投料比应该是
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
-
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)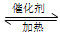 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
-
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。
 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 | …… |
| 平衡常数K | 4.1×106 | K1 | K2 | …… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
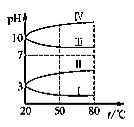
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
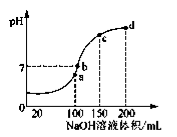
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。












 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。

