-
过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为 __________;基态 Mn原子核外有____种运动状态不同的电子,M层的电子云有_______种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是 ____________________________________
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验 K+的存在。与NO2-互为等电子体的微粒__________(写出一种),K3[Co(NO2)6]中存在的作用力有___________a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH4-的空间构型为____________
(5)FeO 是离子晶体,其晶格能可通过下图中的 Born—Haber 循环计算得到。

可知,O原子的第一电子亲和能为 ________kJ•mol-1,FeO晶格能为________kJ•mol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中 Cu 均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为_______________,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为_________pm
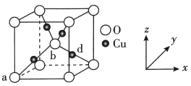
(列出计算式即可)
-
过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Mn原子核外有__个未成对电子,M层的电子云有__种不同的伸展方向。金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“__理论”解释。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是__。
(3)NO 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO 的中心原子的杂化形式为__,空间构型为__。大π键可用符号
的中心原子的杂化形式为__,空间构型为__。大π键可用符号 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为 ,则NO
,则NO 中大π键应表示为__。
中大π键应表示为__。
(4)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d点的坐标参数为__,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
),则d点的坐标参数为__,已知该晶体的密度为ρg•cm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。

-
金属材料在日常生活、生产中有着广泛的应用,下列关于金属的说法不正确的是
A.越活泼的金属越难冶炼
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Al都是用电解其熔融的氯化物制得的
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
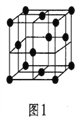
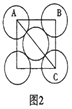
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
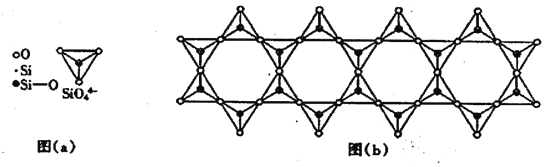
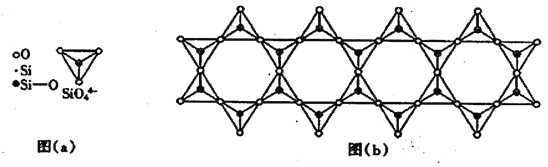
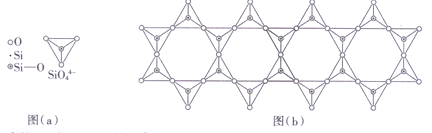
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
-
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
-
[化学一选修3:物质结构与性质](15分)第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO) ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO) 的晶体类型为________,Ni(CO)
的晶体类型为________,Ni(CO) 易溶于下列_______(填选项字母)中。
易溶于下列_______(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________FeO(填“>”或“<”),原因为_____________;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20 水中的溶解度之比为0.39,其原因为_________。
水中的溶解度之比为0.39,其原因为_________。
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________,其化学式为_________。
-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
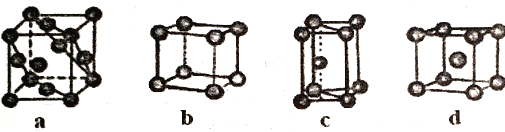
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
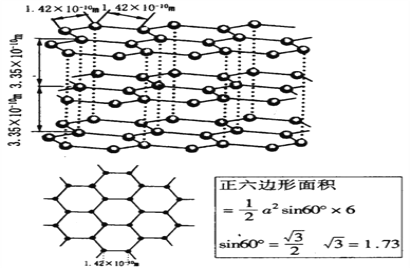
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
-
金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3∶1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5 mol/L盐酸140 mL,恰好完全溶解,所得溶液还能吸收标况下0.56 L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。
-
金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3:1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl 3 溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5mol/L盐酸140mL,恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。









