-
下列叙述中正确的是 ( )
A.常温常压下,1 mol羟基(-OH)所含的电子数为10 NA
B.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路中通过0.2 mol电子
C.在标准状况下,11.2 L NO与11.2 L 02混合后气体分子数为0.75 NA
D.l mol Na202,与足量水反应,转移电子的物质的量为2 mol
难度: 中等查看答案及解析
-
向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是
A、Na2SiO3 B、BaCl2 C、FeCl3 D、NaAlO2
难度: 中等查看答案及解析
-
用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A、
B、
C、[H+]和[OH-]的乘积 D、OH-的物质的量
难度: 中等查看答案及解析
-
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L (标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是

难度: 中等查看答案及解析
-
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;
X2+ + Z = X + Z2+ ; Y + Z2+ = Y2+ + Z。这四种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1 mol X和2mol Y,发生如下反应:
X(s) + 2Y(g)
2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
难度: 中等查看答案及解析
-
对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04 参加反应,下列说法正确的是 ( )
A.转移0.5 mol电子 B.生成0.5 mol Cl2
C.参加反应的HC1为1.6 mol D.Cl2是还原产物
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Na+、Cr2 072–、S04 2-
②pH =11的溶液中:CO32-、Na+、N03-、AlO2-
③加入Al能放出H2的溶液中:Cl-、S042 -、N03–、Mg2+
④在由水电离出的c(OH-)= 10–3的溶液中:Na+、Ba2+、Cl-、I-
⑤在溶液中能大量共存,加入NaOH后加热既有气体放出又有沉淀生成的:Ca2+、HC03–、NH4+、AlO2–
⑥能使无色酚酞变红色的溶液:Na+、 Cl -、S2-、S032-
A.①③⑤ B.②④⑤ C.②④⑥ D.④⑤⑥
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.向Mg( HC03)2溶液中加入过量的NaOH溶液:
Mg2+ +2 HC03- +20H-==MgC03↓ +C032-+ 2H20
B.向NH4 Al( S04)2溶液中滴人Ba( OH)2溶液使SO42-反应完全:
2Ba2++ 40H-十Al3++ 2 SO42-==2BaS04↓+Al02- +2H20
C.足够的C02通入饱和碳酸钠溶液中:C02+CO32-+ H20 =2 HC03-
D.向Fe( N03)2溶液中加入稀盐酸:3Fe2+ +4H++N03-==3Fe3++ NO↑+2H20
难度: 中等查看答案及解析
-
在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
(A)pH=3的硝酸跟pH=11的氢氧化钾溶液
(B)pH=3的盐酸跟pH=11的氨水
(C)pH=3的硫酸跟pH=11的氢氧化钠溶液
(D)pH=3的醋酸跟pH=11的氢氧化钡溶液
难度: 中等查看答案及解析
-
将标准状况下的a升氯化氢气体溶于100克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A、
B、
C
D、
难度: 中等查看答案及解析
-
白藜芦醇
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是
A、1mol 1 mol B、3.5 mol 7 mol
C、3.5 mol 6 mol D、6 mol 7 mol
难度: 中等查看答案及解析
-
将一定质量的金属钠放入100ml 0.5 mol·L-1 的氯化铝溶液中,反应后得到无色澄清溶液,其中除水外只含NaCl和NaAlO2,则加入的金属钠的质量是 ( )
A.4.6克 B.3.45 克 C.1.15 克 D.7.9克
难度: 中等查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是 ( )
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+
D.该药剂不适合于胃溃疡患者服用
难度: 中等查看答案及解析
-
下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是 ( )
A.CS2 B.PCl3 C .BeCl2 D.CCl4
难度: 中等查看答案及解析
-
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A、等于p% B、大于p% C、小于p% D、无法判断
难度: 中等查看答案及解析
-
X ﹑ Y ﹑Z ﹑M是元素周期表中前20号元素,其原子序数依次增大,且X ﹑ Y ﹑Z相邻。X 的核电荷数是Y 的核外电子数的一半,Y与M可形成化合物M2Y。则下列说法正确的是 ( )
A.还原性: X的氧化物﹥Y的氧化物﹥Z的氢化物
B.简单离子的半径:M的离子﹥Z的离子 ﹥Y的离子﹥X的离子
C.Y X2 ﹑ M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
难度: 中等查看答案及解析
-
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2 NH+ H2= LiNH2+ LiH,下列有关说法正确的是 ( )
A.Li2NH中N的化合价是-l B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
难度: 中等查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气。电极反应式为:C2H6 +180H- -14e-== 2C032一+ 12H20; 7H20+7/2 02+14e - ==140H -.
下列有关此电池的推断错误的是 ( )
A.通氧气的电极为正极
B.参加反应的02与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中OH -向正极移动
难度: 中等查看答案及解析
-
右图为直流电源电解稀Na2SO4 水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是 ( )
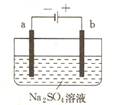
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
难度: 中等查看答案及解析






