-
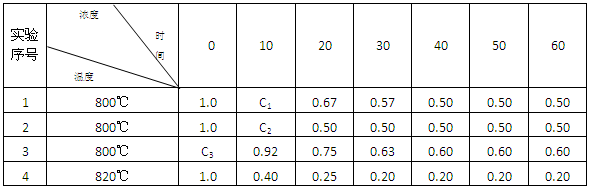
据报导我国最近合成多种元素的新同位素,其中一种是
(铪),它的中子数是( )A.72 B.113 C.185 D.257
难度: 简单查看答案及解析
-
元素周期表中用于制造半导体材料的一些元素,它们是( )
A. 左下方区域的金属元素 B. 稀有气体元素
C. 金属元素和非金属元素分界线附近的元素 D. 右上方区域的非金属元素
难度: 简单查看答案及解析
-
元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子。X和Y所形成的稳定化合物的相对分子质量为( )
A.100 B.95 C.88 D.80
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A. HCl的电子式
B. Cl-的结构示意图
C. CO2的电子式
D. 质量数为37的氯原子37Cl
难度: 简单查看答案及解析
-
下列微粒中,跟NH4+的电子总数和质子总数相同的是( )
A. Ne B. F C. H3O+ D. CH4
难度: 简单查看答案及解析
-
下列递变规律正确的是( )
A. KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D. O、S、Na、K的原子半径依次增大
难度: 简单查看答案及解析
-
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同电子层结构,下列关系正确( )
A.质子数:c>b B.离子的还原性:C2->D-
C.氢化物的稳定性:H2C>HD D.原子半径:B<A
难度: 简单查看答案及解析
-
已知一定温度下,N2 和H2 反应生成2mol NH3时放出的热量为92.0 kJ,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为( )[忽略能量损失]
A.一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定
难度: 简单查看答案及解析
-
在反应H2 + Cl2 = 2HCl中,已知断开1 mol H-H需要能量436 kJ,断开1 mol Cl-Cl需要能量243 kJ,断开1 mol H-Cl需要能量431 kJ,判断该反应是( )。
A. 放出83 kJ热量 B.吸收183 kJ热量
C.反应总能量低于生成物的总能量 D.放出183 kJ热量
难度: 简单查看答案及解析
-
锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( )
①锌极有气泡产生 ②电子由Zn经外电路流向Cu
③负极:Zn +2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移
A. ①②④ B. ①②③ C②. D.②④
难度: 简单查看答案及解析
-
有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是( )
A. d、a、b、c B. b、a、d、c C. d、b、a、c D. d、c、a、b
难度: 简单查看答案及解析
-
在一密闭容器中,加入物质A和B后发生反应aA(S)+bB(g)
cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是 ( )
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 增加少量的A物质,正反应的化学反应速率加快
C. 增大压强,正反应速率加快,逆反应速率也加快
D. 达到平衡时消耗B的物质的量一定等于消耗C的物质的量
难度: 简单查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下反应速率分别如下,其中反应速率最大的是 ( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.3 mol/(L·min) D.v(D)=0.1 mol/(L·min)
难度: 简单查看答案及解析
-
对于可逆反应2SO2+O2
2SO3, 在混合气体中充入一定量的18O2, 足够长的时间后, 18O原子( )
A. 只存在于O2中 B. 只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于SO2、O2和SO3中[
难度: 简单查看答案及解析
-
下图是可逆反应X2 + 3Y2
2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
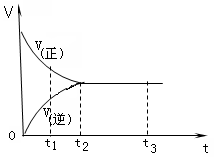
A.t1时,只有正方向反应 B.t2时,反应到达限度
C.t2- t3,反应不再发生 D.t2- t3,各物质的浓度相等
难度: 简单查看答案及解析
-
在一定温度下,反应:2A(s)+2B(g)
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混合气的密度不再随时间而变化 B. C的质量不再改变
C.容器内的压强不随时间而变化 D. 单位时间内生成2a mol B,同时生成a molD
难度: 简单查看答案及解析
-
在密闭容器中,对于反应:2SO2(g)+O2(g)
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80%
难度: 简单查看答案及解析