-
下列有关说法中正确的是( )
A.32S和34S的化学性质相同
B.37Cl原子核内中子数为17
C.12CO2和14CO2互为同分异构体
D.Ca和Ca2+是同种元素,且性质相同难度: 中等查看答案及解析
-
下列各组数据中,其比值为2:1的是( )
A.相同温度下,0.2mol•L-1乙酸溶液与0.1mol•L-1乙酸溶液中c(H+)之比
B.氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH+4):c(SO2-4)
C.Na2CO3溶液中,c(Na+):c(CO2-3)
D.pH=12的BA(OH)2溶液与pH=12的KOH溶液中,c[BA(OH)2]:c(KOH)难度: 中等查看答案及解析
-
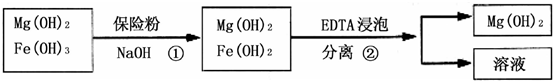
金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”.工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cCaTiCl4+cCO …反应Ⅰ
TiCl4+2MgTi+2MgCl2 …反应Ⅱ
关于反应①、②的分析不正确的是( )
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-.
A.①②④
B.②③④
C.③④
D.②⑤难度: 中等查看答案及解析
-
下列装置不能达到实验目的是( )
A.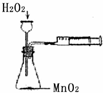
定量测定化学反应速率
B.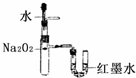
验证Na2O2和水反应的热效应
C.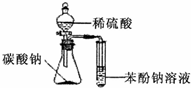
比较硫酸、碳酸、苯酚的酸性
D.
加热烧杯,分离NaCl和NH4Cl难度: 中等查看答案及解析
-
关于下列四个图象的说法中正确的是( )
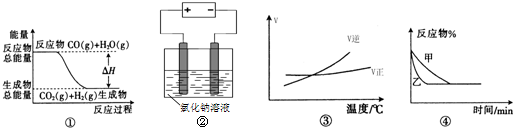
A.图①表示可逆反应“CO(g)+H2O(g)⇌CO2(g)+H2(g)”中的△H大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g)⇌2AB3(g)”的△H小于0
D.图④表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大难度: 中等查看答案及解析
-
香叶醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成.
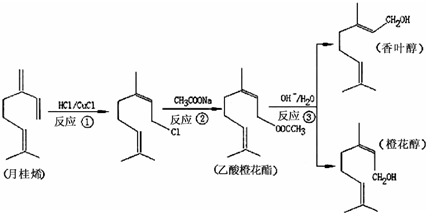
下列说法正确的是( )
A.反应①②③均为取代反应
B.月桂烯分子中所有碳原子全部处在同一平面上
C.香叶醇和橙花醇其实是同一种物质
D.乙酸橙花酯可以发生取代、加成、氧化和聚合反应难度: 中等查看答案及解析
-
一定温度下,将1.0mol的HI(g)通入体积为1.0L的密闭容器中,实验测得HI(g)的最大分解率为22.2%.则该温度下,反应
I2(g)⇌HI(g)平衡常数接近于( )
A.0.02
B.0.15
C.7
D.49难度: 中等查看答案及解析