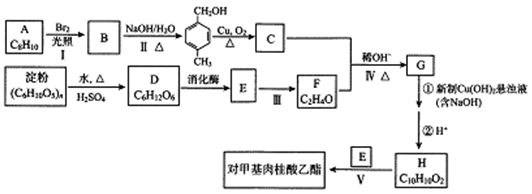
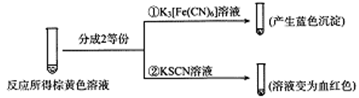
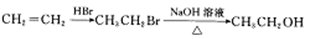-
对下列现象或事实的化学解释不正确的是
选项
现象或事实
化学解释
A
节日焰火五彩缤纷
金属化合物的焰色反应
B
工业上通过煤的干馏制备焦炭
煤的干馏是物理过程
C
用热的纯碱溶液洗去油污
Na2CO3溶于水显碱性
D
用浸泡过高锰酸钾溶液的硅土保鲜水果
乙烯被酸性高锰酸钾氧化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
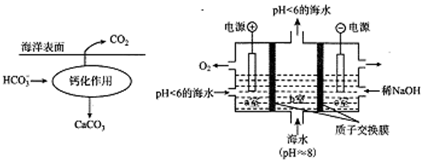
如图为海水综合利用的部分模拟过程。

下列有关说法正确的是
A. ① 中加入试剂顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液
B. 过程②为电解熔融精盐
C. 工业上过程③加入的试剂为浓NaOH溶液
D. 第④步反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 糖类和蛋白质都属于天然高分子化合物
B. 异丁烷的结构简式为

C. CH3COOH和C2H518OH反应,生成CH3COOC2H5和H218O
D.
能与溴水发生加成反应
难度: 中等查看答案及解析
-
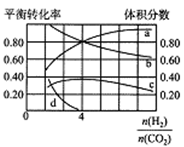
常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的是
A. pH=3的草酸溶液含有H+数目为0.001NA
B. 当1molKMnO4被还原时强酸提供H+数目为NA
C. 1molHOOC-COOH含共用电子对数目为9NA
D. 该反应释放CO2分子数目为
难度: 中等查看答案及解析
-
四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述错误的是
A. 气态氢化物的热稳定性:b<c B. 含d元素的盐溶液可能呈碱性
C. 原子半径:d>c>b>a D. a、b和c三种元素能形成离子化合物
难度: 中等查看答案及解析
-
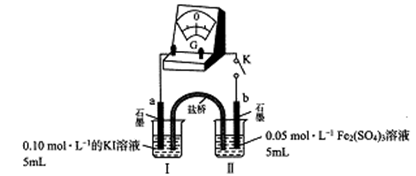
利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)
选项
实验目的
甲
乙
丙
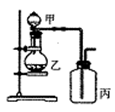
A
证明浓硫酸具有强氧化性
浓硫酸
碳粉
溴水
B
验证Cl2无漂白性
浓盐酸
MnO2
干燥的红色布条
C
验证NH3溶于水显碱性
浓氨水
碱石灰
湿润的蓝色石蕊试纸
D
比较H2CO3和H2SiO3的酸性
硼酸溶液
碳酸钠
硅酸钠溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是
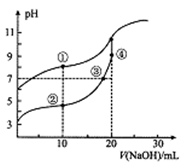
A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
难度: 中等查看答案及解析