-
某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是_______(结合化学用语回答)。
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①② 。
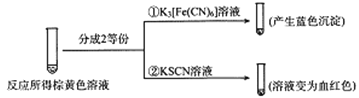
实验①中产生蓝色沉淀的离子方程式为_________,根据以上反应现象写出甲组同学实验中的离了方程式_________,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_________。
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,
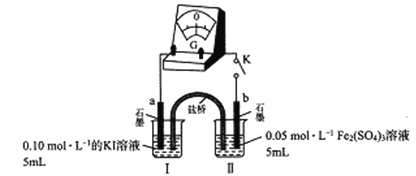
K闭合时,指针发生偏转,盐桥中的阳离子向______极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动。据此分析I-还原性强弱与浓度关系______________。
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入______(填“酸式”或“碱式”)滴定管,选用淀粉济液为指示剂,滴定终点现象为_______________。
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是_________。
-
某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是_______(结合化学用语回答)。
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①② 。
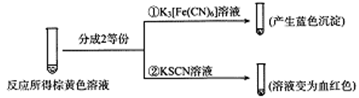
实验①中产生蓝色沉淀的离子方程式为_________,根据以上反应现象写出甲组同学实验中的离了方程式_________,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_________。
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,
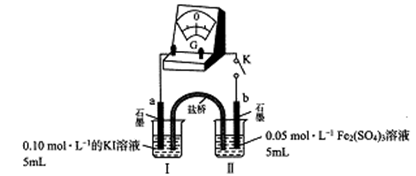
K闭合时,指针发生偏转,盐桥中的阳离子向______极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动。据此分析I-还原性强弱与浓度关系______________。
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入______(填“酸式”或“碱式”)滴定管,选用淀粉济液为指示剂,滴定终点现象为_______________。
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是_________。
-
(15分)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
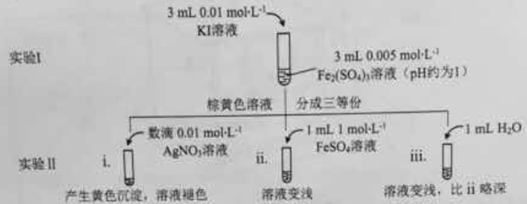
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用下图装置(a、b均为石墨电极)进行实验验证。
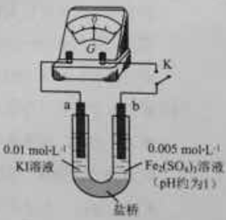
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
-
同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是
A. 若铁粉有剩余,则不溶物中一定有铜
B. 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C. 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+
D. 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+
-
同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )
A.若铁粉有剩余,则不溶物中一定有铜
B.若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C.若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+
D.若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+
-
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1) 如何检验绿矾晶体中Fe2+是否被氧化?_______________________________
(2)已知本实验所用绿矾晶体没有被氧化。为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2) (设为装置A) 称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
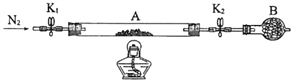
①将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量装置A的质量 f.冷却到室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_____________(列式表示) 。若实验时按a、d次序操作,则使x_____________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2) 中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为__________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_____________。
A.品红 B.NaOH C.BaCl2 D.Ba(NO3)2 E.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_______________。
(4) 绿矾溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式____________________。
-
已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4。某兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是_______________________。
(2)乙同学先将少量黑色粉末X放入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4 .
①滴加KSCN溶液的目的是__________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示)______________________。
(3)丁同学的实验方案

操作Z是_________. 通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为___________。
(4)若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程
式为 。
-
已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案:
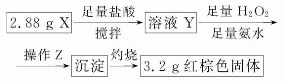
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
-
化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
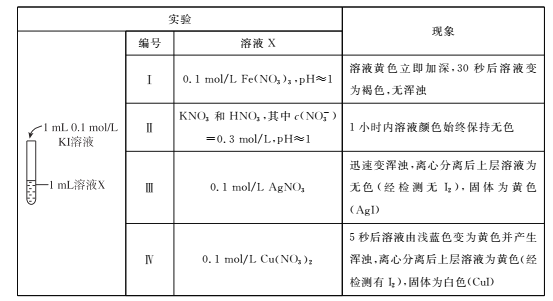
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。
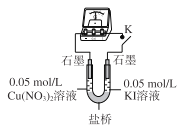
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
-
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步 具有极其重要的意义。
I.某化学兴趣小组为探究Ag+和Fe3+氧化性,设计了如下实验:
第一步:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
第二步:为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水。请完成下表:
| 操 作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 | (1) | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 (2) ,振荡 | (3) | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+,氧化性:Ag+ Fe3+(填“大于”或“小于”)。
Ⅱ.生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
(1)NaCl和Cl2中化学键的类型分别是 和 。
(2)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
Ⅲ.将32 g铜与l40 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。











