-
化学与生活密切相关。下列说法正确的是
A. 植物油的主要成分是不饱和高级脂肪酸甘油酯
B. 尼龙绳、宣纸均可由合成纤维制造
C. 淀粉和纤维素都是人体中能量的重要来源
D. 酶是生物体内重要的催化剂,仅由碳、氢、氧三种元素组成
难度: 简单查看答案及解析
-
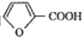
已知有机物
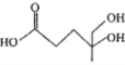 是合成青蒿素的原料之一。下列有关该有机物的说法正确的是
是合成青蒿素的原料之一。下列有关该有机物的说法正确的是A. 分子式为C6H11O4
B. 可与酸性KMnO4溶液反应
C. 既能发生取代反应,又能发生加成反应
D. 是乙酸的同系物,能和碳酸钠反应
难度: 中等查看答案及解析
-
ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
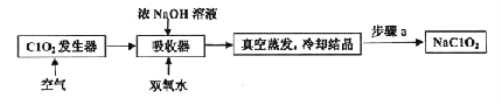
A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+ H2O2=2ClO2-+2H+ +O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A. 0.1 mol NaHSO4晶体中,含有H+的数目为0.1NA
B. 28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4NA
C. 1L 0.1 mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1NA
D. 质量均为22g的T2O与D218O中所含中子数均为12NA
难度: 中等查看答案及解析
-
a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与电子层数相同,b的最高和最低化合价的代数和为0,c的最高价氧化物对应的水化物为强碱,d与b同族。下列叙述错误的是
A. 原子半径:a<b<d<c
B. c的单质在着火时不能用水灭火
C. 向d的含氧酸钠盐溶液中通入b的最高价氧化物,有白色沉淀析出
D. a、b形成的化合物一定能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是

A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1 mol NO,可同时得到32g O2
难度: 中等查看答案及解析
-
常温下用0. 1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
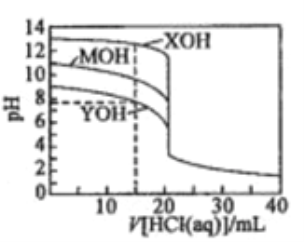
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00 mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[ HCl(aq)]=20.00 mL时,三种溶液中水的电离程度:XOH> MOH> YOH
D. V[HCl(aq)]=40.00 ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
难度: 中等查看答案及解析
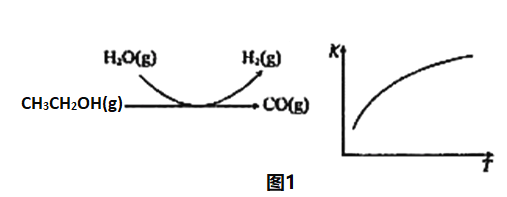
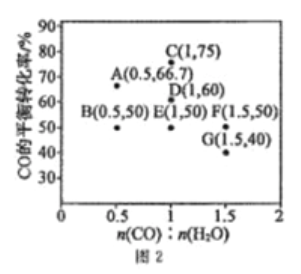
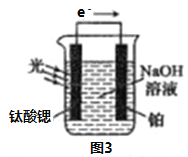
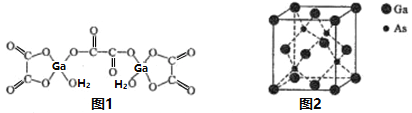
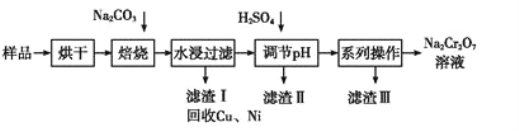
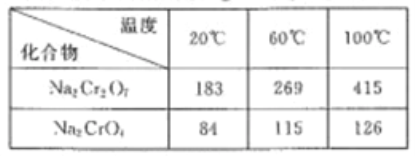
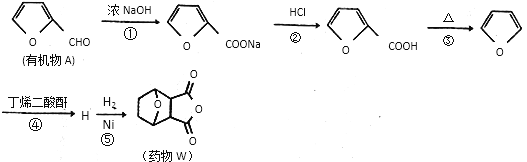
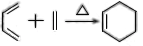
 制备丁烯二酸酐
制备丁烯二酸酐