-
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
A.NO2 B.SO2 C.SO3 D.CO2
难度: 中等查看答案及解析
-
下列说法正确的是
A.将Ca(OH)2饱和溶液加热,溶液的pH增大
B.常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7
C.将0.1mol·L-1的HI溶液加水稀释100倍,溶液中所有离子的浓度随之减小
D.两种醋酸溶液的pH分别为a和(a+l),物质的量浓度分别为c1和c2, 则c1=10c2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 电解熔融的氧化铝制取金属铝用铁作阳极
B. 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
C. 在镀件上镀铜时可用金属铜作阴极
D. 除去MgCl2溶液中的CuCl2既可用MgO也可用Mg(OH)2
难度: 中等查看答案及解析
-
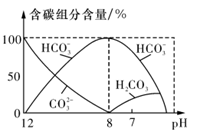
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O
HCOO-+H3O+
B.CO2+H2O
HCO3-+H+
C.CO32-+H2O
HCO3-+OH-
D.HS-+H2O
S2-+H3O+
难度: 中等查看答案及解析
-
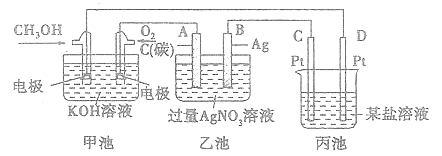
下列电池工作时能量转化形式与其他三个不同的是( )

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某溶液在250C时由水电离产生的H+浓度为1.0×1012 mol· L1,下列说法不正确的是( )
A. 该溶液的pH可能为2
B. 向该溶液中加入铝片一定有氢气产生
C. 若该溶液中的溶质只有一种,它可能是酸、碱或盐
D. HCO3、HS、HPO42等离子在该溶液中不能大量共存
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.用加热的方法可除去KNO3溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
难度: 中等查看答案及解析
-
四种水溶液①HCl,②FeCl3,③KOH,④Na2SO3其 PH值依次为4、4、10、10,而溶液中水的电离程度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A. α1=α2=α3=α4 B. α1>α3>α2>α4
C. α4=α2>α3=α1 D. α1=α3>α2=α4
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
A.CuCl2 [CuSO4] B.NaOH [NaOH]
C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
难度: 中等查看答案及解析
-
下列溶液中离子浓度关系的表示正确的是( )
A. 在0.1mol·L-1 KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4)+c(OH)+c(C2O42)
B. 0.lmol/L的Na2S溶液中,c(OH-)= c(H+)+ c(HS)+c(H2S)
C. 0.1 mol·L-1的NH4NO3溶液中:c(NO3)>c(H+)>c(NH
)>c(OH)
D. 物质的量浓度相等的HCOOH和HCOONa溶液等体积混合后的溶液中:2c(Na+)=c(HCOO)+c(HCOOH)
难度: 困难查看答案及解析
-
室温下0.1mol/L的NH4CN溶液的pH等于9.32.下列说法错误的是( )
A. 上述溶液中NH4+的水解程度大于CN的水解程度
B. 室温下,HCN是比NH3•H2O更弱的电解质
C. 上述溶液能使甲基橙试剂变黄色,石蕊试液变蓝
D. 室温下,0.1mol/LNaCN溶液中,CN的水解程度小于上述溶液中CN的水解程度
难度: 中等查看答案及解析
-
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是

A.稀释前,c(HX)=0.01 mol/L B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-) D.溶液的导电性:a>b
难度: 困难查看答案及解析
-
已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO
,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是
A. 该温度高于25℃ B. 水电离出的c(H+)=1×10-10 mol·L-1
C. c(H+)=c(OH-)+c(SO
) D. 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
难度: 中等查看答案及解析
-
如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
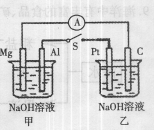
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH增加
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
难度: 简单查看答案及解析
-
常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A. 加入适量的NaCl,可使c(NH
)=c(Cl-)
B. 滴加几滴浓氨水,c(NH
)减小
C. 滴加几滴浓盐酸,
的值减小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH
)比该混合溶液中的大
难度: 困难查看答案及解析
-
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图
装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上
无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
 A. 图1为原电池装置,Cu电极上产生的是O2
A. 图1为原电池装置,Cu电极上产生的是O2B. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C. 由实验现象可知:金属活动性Cu>Cr
D. 两个装置中,电子均由Cr电极流向Cu电极
难度: 中等查看答案及解析
-
某些盐能溶解沉淀,利用下表三种试剂进行实验,相关分析不正确的是( )
编号
①
②
③
分散质
Mg(OH)2
HCl
NH4Cl
备注
悬浊液
1 mol/L
1 mol/L
A. 向①中加入酚酞,溶液显红色说明物质的“不溶性”是相对的
B. 分别向少量Mg(OH)2沉淀中加入适量等体积的②③,沉淀均能快速彻底溶解
C. ①③混合后发生反应:Mg(OH)2(s)+2NH
Mg2++2NH3·H2O
D. 向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
难度: 中等查看答案及解析
-
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )
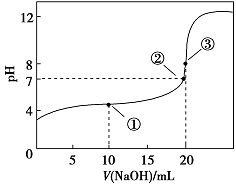
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 困难查看答案及解析
-
下列有关能级的能量高低排列正确的是( )
A. 3p>3s B. 1s=2s C. 3d<4s D. 4px=3py
难度: 简单查看答案及解析
-
已知溴酸银的溶解是吸热过程,在不同温度条件下,溴酸银的溶解平衡曲线如图所示,下列说法正确的是( )
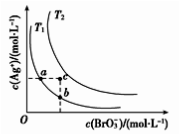
A. T1>T2
B. 加入AgNO3固体,可从a点变到c点
C. a点和b点的Ksp相等
D. c点时,在T1、T2两个温度条件下均有固体析出
难度: 困难查看答案及解析
-
在一定体积某浓度的Ba(NO3)2溶液中.逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是
A.10:1 B.1:10 C.9:1 D.1:9
难度: 简单查看答案及解析
-
已知Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38常温下,向1.0mol Fe2(SO4)3和1.0mol FeSO4的1L酸性混合溶液中通入NH3,至该溶液的pH为 3时,溶液体积变化忽略不计,所得溶液中c(Fe2+):c(Fe3+)的值为( )
A . 2:1 B. 1:1 C. 2.5×104:2 D. 2.5×104:1
难度: 中等查看答案及解析
-
碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O
KIO3+3H2↑,有关说法不正确的是
A.石墨作阳极,不锈钢作阴极
B.I-在阳极放电,H+在阴极放电
C.电解过程中电解质溶液的pH变小
D.电解转移3 mol e-时,理论上可制得KIO3 107 g
难度: 中等查看答案及解析
-
部分弱酸的电力平衡常数如下表所示:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
下列选项正确的是( )。
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
难度: 困难查看答案及解析
-
锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。下列有关说法正确的是( )

A.充电时Zn2+通过阳离子交换膜由左侧流向右侧
B.放电时每转移2mol电子负极增重130g
C.充电时阴极的电极反应式为Br2+2e-=2Br-
D.若将电解液改为氯化锌溶液放电效果更好更安全
难度: 中等查看答案及解析