-
下列有关物质应用的说法正确的是
A.烧碱可做食品干燥剂 B.经常接触铅笔芯易造成铅中毒
C.盐类都可以用作调味品 D.蚕丝的主要成分是蛋白质
难度: 简单查看答案及解析
-
分子式为C7H12O4,其中只含二个—COOCH3基团的同分异构体(不考虑手性异构)共有
A.4种 B.5种 C.6种 D.7种
难度: 简单查看答案及解析
-
将足量的稀盐酸加到由下列物质组成的固体混合物中,只能发生一种类型反应的是
A.Al、Cu、AgNO3 B.Na2O2、Na2SO3、BaCl2
C.CaCO3、Na2SiO3、CH3COONa D.Ba(NO3)2、Fe(OH)2、NaOH
难度: 中等查看答案及解析
-
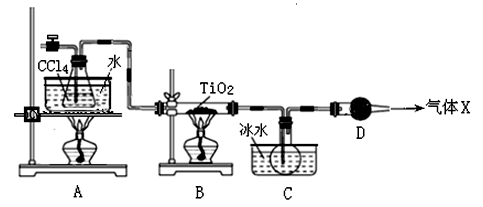
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用右图所示装置探究废旧塑料的再利用。下列叙述错误的是
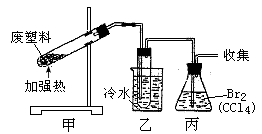
A.装置乙的试管中可收集到芳香烃
B.装置丙中的试剂可吸收烯烃以获得卤代烃
C.最后收集的气体可做燃料
D.聚丙烯的链节是—CH2—CH2—CH2—
难度: 中等查看答案及解析
-
镁电池放电时电压高而平稳,镁电池成为人们研制的绿色电池,一种镁电池的反应式为
xMg+Mo3S4
MgxMo3S4,下列说法中正确的是
A.充电时MgxMo3S4只发生还原反应
B.放电时Mo3S4只发生氧化反应
C.充电时阳极反应式为 Mo3S42x-—2xe-= Mo3S4
D.放电时负极反应式为xMg= xMg2+—2xe-
难度: 简单查看答案及解析
-
下列关于0.5mol·L—1NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++H++CO32—
B.加水稀释后,n(H+)与n(OH—)的乘积变大
C.离子浓度关系:c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ c(CO32—)
D.温度升高,c(HCO3—)增大
难度: 简单查看答案及解析
-
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A.若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B.若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C.若丙中含有第2周期ⅣA族的元素,则丙可能是甲烷的同系物
D.若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有—1价的元素
难度: 简单查看答案及解析