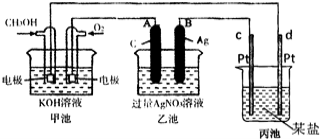
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4LCCl4含有C—Cl键的数目为4NA
B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA
C.反应NH4N3
2N2↑+2H2↑,标准状况下每生成22.4LN2,转移电子的数目为2 NA.
D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g
难度: 简单查看答案及解析
-
用下图表示的一些物质或概念间的从属关系不正确的是( )
X
Y
Z
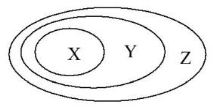
A
酸
化合物
纯净物
B
单质
金属单质
纯净物
C
胶体
分散系
混合物
D
碱性氧化物
氧化物
化合物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 分散系中分散
质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B. 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
C. 钢铁发生电化学腐蚀时,负极的电极反应式为 Fe﹣3e﹣=Fe3+
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
难度: 中等查看答案及解析
-
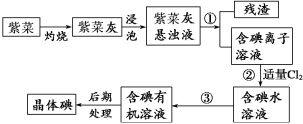
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤,正确的操作顺序( )
A. ①②③⑤④ B. ③②①⑤④ C. ②③①④⑤ D. ③⑤②①④
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K
+、Ba2+、Cl-、Br-
B.常
温下
=12的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液中:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
难度: 简单查看答案及解析
-
下列关于各图的说法,正确的是 ( )
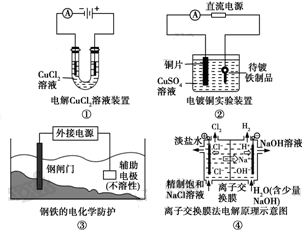
A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
难度: 简单查看答案及解析
-
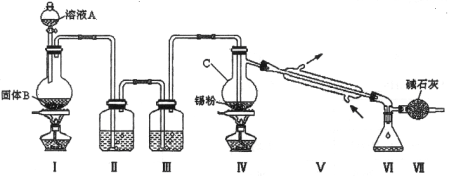
下列实验操作中正确的是( )
A. 分液时,先从分液漏斗下口放出下层液体,更换烧杯后再打开旋塞放出上层液体
B. 蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上进水口流入,下进水口流出
C. 分离硝酸钾与氯化钾时,冷却结晶时析出的是溶解度随温度变化较大的固体
D. 用托盘天平称量10.2 g固体时,如果砝码误放于左盘,固体放在右盘,则实际称得的固体质量大于10.2 g
难度: 简单查看答案及解析
-
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaO
H溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
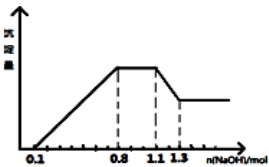
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
难度: 简单查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将1 mol Cl2通入到含1 mol FeI2溶液中:
2Fe2++2I-+2Cl2==2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Mg(HC
O3)2溶液与足量的NaOH溶液反应:
Mg2++HCO
+OH-==MgCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO-==HClO+HSO
正确;说明酸性:
H2SO3强于HClO
D
1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO
+5H+==Al3++Al(OH)3↓+H2O
正确;AlO
与Al(OH)3消耗的H+的物质的量之比为2∶3
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:P
b(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O
Al2O3+3H2,电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成2molAl2O3
C
正极:PbO2+4H++2e═Pb2++2H2O
阳极:2Al+3H2O−6e−═Al2O3+6H+
D
难度: 中等查看答案及解析