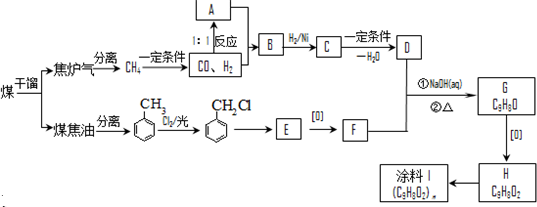
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe.有关该电池的下列说法中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.将铁粉加入稀硫酸中2Fe+6H+=2Fe3++3H2↑
B.将磁性氧化铁溶于盐酸Fe3O4+8H+=3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合Fe2++4H++NO3-=Fe3++2H2O+NO↑
D.将铜屑加Fe3+溶液中2Fe3++Cu=2Fe2++Cu2+难度: 中等查看答案及解析
-
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O2与18O2核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同难度: 中等查看答案及解析
-
减缓温室气体排放是2009年哥本哈根气候变化会议的议题.下列反应不产生温室气体的是( )
A.用纯碱制玻璃
B.用煤炭作燃料
C.用铁矿石炼铁
D.用氨制碳酸铵难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑
B.三氟化氮的电子式:
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.羟基乙酸(HOCH2COOH)的缩聚物:难度: 中等查看答案及解析
-
下表各组物质中,满足图物质一步转化关系的选项是( )
选项 X Y Z ① Na NaOH NaHCO3 ② Cu CuSO4 Cu(OH)3 ③ C CO CO2 ④ Si SiO2 H2SiO3 
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
在下列条件下,一定能大量共存的离子组是( )
A.无色透明的水溶液中,K+、Mg2+、I-、MnO4-
B.pH=1的NaNO3的水溶液中,NH4+、Fe2+、SO42-、Cl-
C.c(HCO3-)=0.1mol/L的溶液中,Na+、K+、、Br-
D.由水电离产生的c(OH-)=1×10-14mol/L的溶液中,H+、Al3+、Cl-、NO3-难度: 中等查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )

A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g)+Q(Q>0)正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时(Mn2+是该反应的催化剂),n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g)+Q(Q>0),使用和未使用催化剂时,反应过程中的能量变化难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱难度: 中等查看答案及解析
-
由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应.若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是( )
A.4:3
B.3:2
C.3:1
D.2:l难度: 中等查看答案及解析
-
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:
 对该“光敏性高分子”叙述正确的是( )
对该“光敏性高分子”叙述正确的是( )
A.化学式为(C11H11O2)n
B.1mol该分子最多能和4nmolH2发生加成反应
C.它可以和FeCl3溶液发生显色反应
D.它能发生加成反应,不能发生水解反应难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系不正确的是( )
A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③
B.将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
C.0.1mol•L-1 K2HPO4和0.2mol/L KH2PO4的混合溶液:c(K+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-)
D.0.1mol•L-1 CH3COONa与0.15mol•L-1 HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)难度: 中等查看答案及解析