-
化学与生产密切相关,下列有关说法错误的是
A. 我国很多城市都在发布“空气质量日报”,列入的首要污染物不包括二氧化碳
B. 碳酸钠溶液可以用作锅炉除垢时,CaSO4沉淀的转化剂
C. 食品包装袋中常有硅胶、生石灰、还原性铁粉等,其作用不完全相同
D. 人工制造的分子筛是一种有机高分子材料
难度: 中等查看答案及解析
-
1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,则
A. 反应的热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH= +483.6 kJ·mol-1
B. 2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量
C. 1 mol H2O(1)的能量大于1 mol H2O(g)的能量
D. 氢气的燃烧热为241.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A. 干燥的氯气一定不能使鲜花褪色
B. 金属氧化物与酸反应都只生成盐和水
C. 明矾净水、纯碱去油污都是利用的水解原理
D. 在元素周期表左下方区域的金属元素中可以寻找制造半导体的材料
难度: 中等查看答案及解析
-
下列会学用语或物质的性质描述正确的是
A. 乙烯在一定条件下能发生加成反应,加聚反应,被酸性高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸
B. 符合分子式为C3H8O的醇有三种不同结构
C. 右图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷
D. 治疗疟疾的青蒿素(如图)易溶于水

难度: 中等查看答案及解析
-
下列描述不正确的是

A. 图1能验证乙炔的还原性
B. 图2可用于实验室制O2
C. 图3可以看出催化剂不能改变反应的焓变
D. 图4表示KNO3的溶解度曲线,图中a点所表示的溶液时80℃时KNO3的不饱和溶液
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是

A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
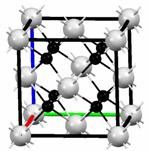
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
工业上,用火法炼铜的流程如下:
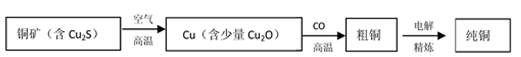
下列说法不正确的是
A. 铜矿灼烧产生的尾气可用氨水吸收制成化工产品
B. 电解法精炼粗铜的过程中,用硫酸铜溶液作电解质溶液
C. 在Cu2O与 CO反应时,CO被还原成CO2
D. 粗铜精炼时,贵重金属如金、银沉于阳极泥中
难度: 中等查看答案及解析

 。下列是聚乙烯醇桂酸酯的一种合成路线
。下列是聚乙烯醇桂酸酯的一种合成路线

 设计合成路线。
设计合成路线。