-
下列过程中发生了化学变化的是( )
A. 铁水铸锅 B. 石蜡熔化 C. 钢铁生锈 D. 水的蒸发
难度: 简单查看答案及解析
-
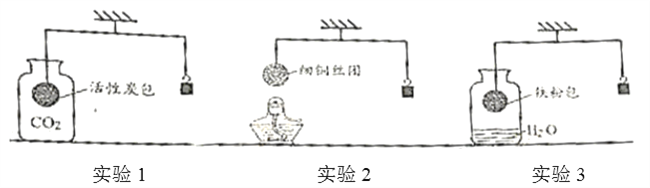
单质金的性质有:①美丽的光泽;②较好的导电性;③很好的延展性;④很强的耐腐蚀性。经常被人们加工成饰品是利用了金具有的哪些性质( )
A. ①② B. ①②④ C. ①③④ D. ①②③④
难度: 简单查看答案及解析
-
金属活动性顺序在工农业生产和科学研究中有重要应用,常见金属在溶液中的活动性由强至弱的顺序及元素名称、符号均正确的一组是
A.金Au>银Ag>铜Cu B.钾K>钙Ca>钠Na
C.锌Zn>铁Fe>贡Hg D.铝Cl>镁Mg >锌Zn
难度: 简单查看答案及解析
-
图中A、B、C、D是立在水田中的电线杆的铁丝拉线的四个部位,其中最容易生锈的是( )
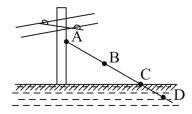
A.A处 B.B处 C.C处 D.D处
难度: 中等查看答案及解析
-
合金由于其优良的性能在生产生活中得到了广泛的使用。下列关于合金及纯金属的各项比较中,不正确的是( )
A. 含碳量:生铁>钢 B. 抗腐蚀能力:不锈钢>纯铁
C. 硬度:纯铜>黄铜 D. 熔点:纯锡>武德合金
难度: 简单查看答案及解析
-
下列属于置换反应的是
A.2H2O
2H2↑+O2↑ B.H2+CuO
Cu+H2O
C.S+O2
SO2 D.NaOH+HCl=NaCl+H2O
难度: 中等查看答案及解析
-
将金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A. R>Cu B. R>Fe C. Zn>R D. R>Ag
难度: 中等查看答案及解析
-
保险丝的作用是当电路上电流过大时,使其中的金属线(或片)产生高温而熔断,以保护电路免于受到伤害。所以家庭电路中的保险丝,除了要具有良好的导电性外,还一定要具有( )
A. 较小的密度 B. 较小的硬度 C. 较低的熔点 D. 较高的熔点
难度: 简单查看答案及解析
-
现有甲、乙、丙、丁四种颗粒大小相同的金属,分别投入相同的稀硫酸中,只有甲、乙表面有气泡产生,且甲产生气泡较快;再把丙和丁投入相同的硝酸银溶液中,过一会儿,丙的表面有银析出,而丁没有变化。则四种金属的活动性顺序是( )
A. 甲>乙>丁>丙 B. 丁>乙>丙>甲
C. 甲>乙>丙>丁 D. 乙>甲>丁>丙
难度: 中等查看答案及解析
-
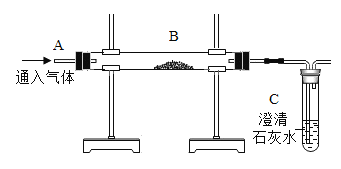
如图是某同学设计的冶炼铁的实验装置,下列有关说法中正确的是( )

A.该实验开始时应先通CO一段时间,再加热
B.该反应属于置换反应
C.该实验设计合理,没有任何缺陷
D.该反应与CO还原CuO的反应原理、装置完全相同
难度: 中等查看答案及解析
-
在氯化铜和氯化镁的混合溶液中加人过量铁粉,充分反应后过滤,留在滤纸上的是( )
A. Fe 和 Cu B. Mg和Cu C. Fe D. Cu
难度: 困难查看答案及解析
-
除去下列物质中少量杂质,所选试剂错误的是( )
选项
物质
杂质
试剂
A
炭粉
铁粉
稀盐酸
B
一氧化碳
二氧化碳
灼热的氧化铜
C
氯化钾固体
二氧化锰
水
D
氧化铜
铜
氧气
难度: 中等查看答案及解析
-
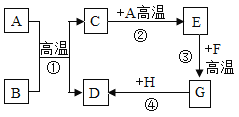
某同学为探究镁、锌、铜、银的活动性顺序,设计如图试验流程:依据流程设计,下面对物质①②的选择合理的是( )
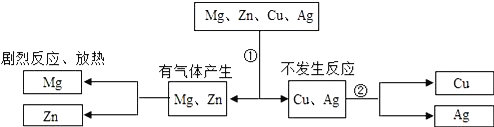
A. ①稀硫酸 ②硫酸铜 B. ①稀盐酸 ②硫酸锌
C. ①稀盐酸 ②硫酸亚铁 D. ①稀硫酸 ②氯化镁
难度: 简单查看答案及解析
-
两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是( )
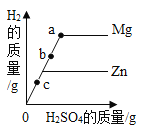
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
难度: 中等查看答案及解析