-
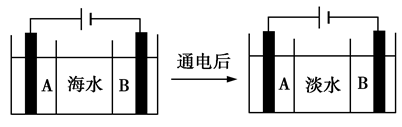
核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是( )
A. 核反应发电实现了化学能到电能的转化
B. 115 号元素一定是处于VA 族的非金属元素
C. 117 号元素与F 、Cl 、Br 、I 均处于VIIA 族
D. 四种新元素位于元素周期表中的不同周期
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.云、烟、雾等均能产生丁达尔现象
B.开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.用脱硫处理的煤代替原煤作燃料可以有效减少空气中CO2气体的含量
难度: 简单查看答案及解析
-
在2015年9月3日胜利日大阅兵中,八一飞行
表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )

A.“彩雾”是一种混合物
B.上述过程中有物理变化
C.燃料燃烧产生的热量促使拉烟剂气化
D.“彩雾”的形成与焰色反应的原理相同
难度: 简单查看答案及解析
-
将1.5mL 0.1mol/L Na2SO4溶液和1.0mL 0.1mol/L BaCl2溶液混合后得到浊液a ,过滤得到滤液b和白色沉淀c。下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:
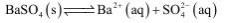
B.若向滤液b中滴加0.01mol/L Na2SO4溶液,无明显现象
C.若向滤液b中滴加0.01mol/L BaCl2溶液,会出现白色沉淀
D.若向滤液b中滴加0.1mol/L AgNO3溶液,无明显现象
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数。下列说法正确的是( )
A.标准状况下,
2.24 L H2O的分子数为0.1NA
B.0.1 mol Na2O2中含有的阴离子数目为0.2NA
C.4.4 g CO2气体中含有的原子总数为0.3NA
D.1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA
难度: 简单查看答案及解析
-
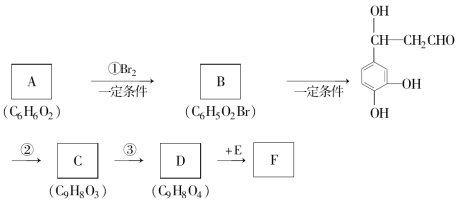
下列图中的实验方案,能达到实验目的的是( )
实验方案
实验目的
A

验证FeCl3对H2O2分解反应有催化作用
B
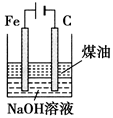
制备Fe(OH)2并能较长时间观察其颜色
C
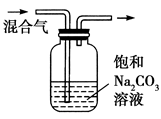
除去CO2气体中混有的SO2
D
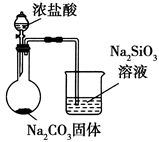
比较HCl、H2CO3和H2SiO3的酸性强弱
难度: 中等查看答案及解析
-
下列对有机物结构或性质的描述,错误的是( )
A. 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
B. 苯分子中的碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键
C. 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D. 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
难度: 简单查看答案及解析
-
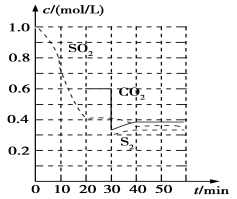
稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4, MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是( )
A.MnO2吸收SO2的反应:
B.MnO2作为碱
性电池正极材料时的放电反应:
C.MnSO4与KMnO4反应制备

D.尾气中的SO2 还可用足量的氨水吸收:
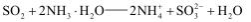
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是(
)
A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:HCO
+OH-===CO
+H2O
C.MnO2与浓盐酸反应制Cl2:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
D.大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
分子式为C8H8的两种同分异构体X和Y。X是一种芳香烃,分子中只有一个环;Y俗称立方烷,其核磁共振氢谱显示只有一个吸收峰。下列有关说法错误的是( )
A. X、Y均能燃烧,都有大量浓烟产生
B. X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C. X属于苯的同系物
D. Y的二氯代物有2种
难度: 中等查看答案及解析
-
向10 mL 0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
A.x=10时,溶液中有NH
、Al3+、SO
、且c(NH
)=c( SO
)>c(Al3+)
B.x=15时,溶液中有NH
、SO
,且c(NH
)<2c(SO
)
C.x=20时,溶液中有NH
、Al3+、OH-,
且c(OH-)>c(Al3+)
D.x=30时,溶液中有Ba2+、AlO
、OH-,且c(OH-)=c(Ba2+)
难度: 困难查看答案及解析
-
某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生
反应A(g)+3B(g)
2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
A.原混合气体的体积为1.1VL
B. 原混合气体的体积为1.2VL
C.反应达到限度时,气体A消耗掉0.05 VL
D.反应达到限度时,气体B消耗掉0.05 VL
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液
难度: 简单查看答案及解析
-
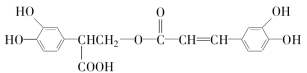
化合物A是一种新型锅炉水除氧剂,其结构式如图所示,下列说法中正确的是( )
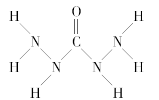
A.A中氧元素非金属性最强,故只有氧元素显负价
B.由A中的四种元素组成的化合物可能是离子化合物
C.A分子中存在两类共价键
D.A分子中氮原子没有孤电子对而氧原子有
难度: 中等查看答案及解析