-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.N2的电子式:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D.邻羟基苯甲酸的结构简式:
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.常温下浓硫酸能是铝发生钝化,可在常温下作用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的若,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
常温下,下列各组离子在制定溶液中一定能大量共存的是
A. 1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
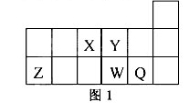
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C.离子Y2-和Z 3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+==Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O==NO3-+NO+2H+
C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O==2Al(OH)3
+CO32-
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是

A.用水湿润pH试纸测量某溶液的pH
B.用量筒量取20mol ▪L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol▪L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置出去Cl2中的少量HCl
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.1mol甲醇中含有C-H键的数目为4NA
B.25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24L已烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4 NA
难度: 中等查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是

A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
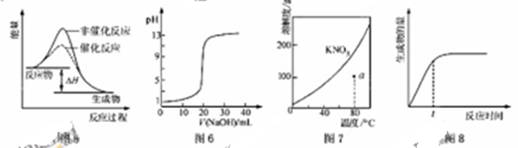
A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图6表示0.1000mol •L-1NaOH溶液滴定20.00mL0.1000mol •L-1CH3COOH溶液所得到的滴定曲线
C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 中等查看答案及解析
-
β--紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
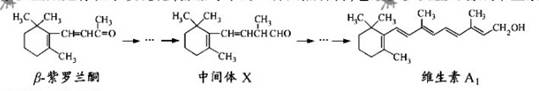
下列说法正确的是
A.β--紫罗兰酮可使酸性KMnO4溶液褪色
B.1mol中间体X最多能与2mol H2发生加成反应
C.维生素A1易溶于NaOH溶液
D.β--紫罗兰酮与中间体X互为同分异构体
难度: 中等查看答案及解析
-
下列说法正确的是
A.一定温度下,反应MgCl2(1) ==Mg(1)+ Cl2(g)的
B.水解反应NH+4+H2O
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2==2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I-3
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1mol·L-1NaHCO3溶液中:c(Na+)
c(HCO3+)
c(CO32-)
c(H2CO3)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-)+2c(H2CO-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:
c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1mol·L-1]:
c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
难度: 中等查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
反应时间/min
n(CO)/mol
H2O/ mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是
A.反应在t1min内的平均速率为
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
非选择题
难度: 中等查看答案及解析

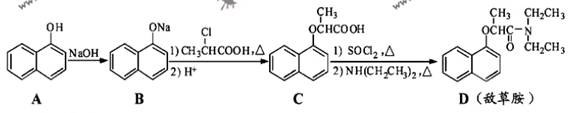
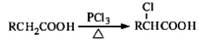 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备